Un peu de chimie est parfois nécessaire !
Un peu de chimie est parfois nécessaire !
Ci-dessous, une courte introduction à la série de podcast sur ce chapitre :
Ci-dessous, le contenu écrit de cette page lu par Terres du Passé :
Évoquer la chimie éveille assez facilement l'image de ces scientifiques un peu fous qui se plaisent à mélanger diverses potions colorées les unes avec les autres et qui produisent des explosions, de la fumée dense et colorée ou encore des mousses foisonnantes à la texture onctueuse !
Mais la chimie est bien plus que cela !
Elle est à la base de tout ce qui existe...
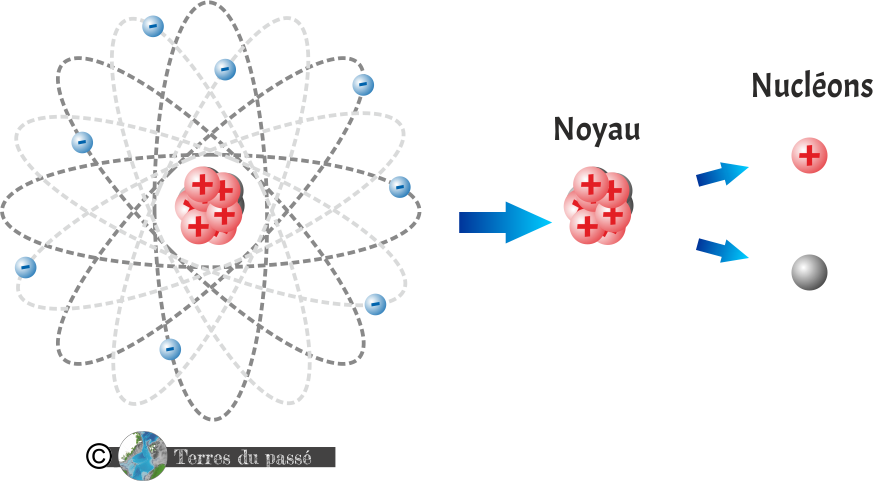
Qu'est-ce qu'un atome ?
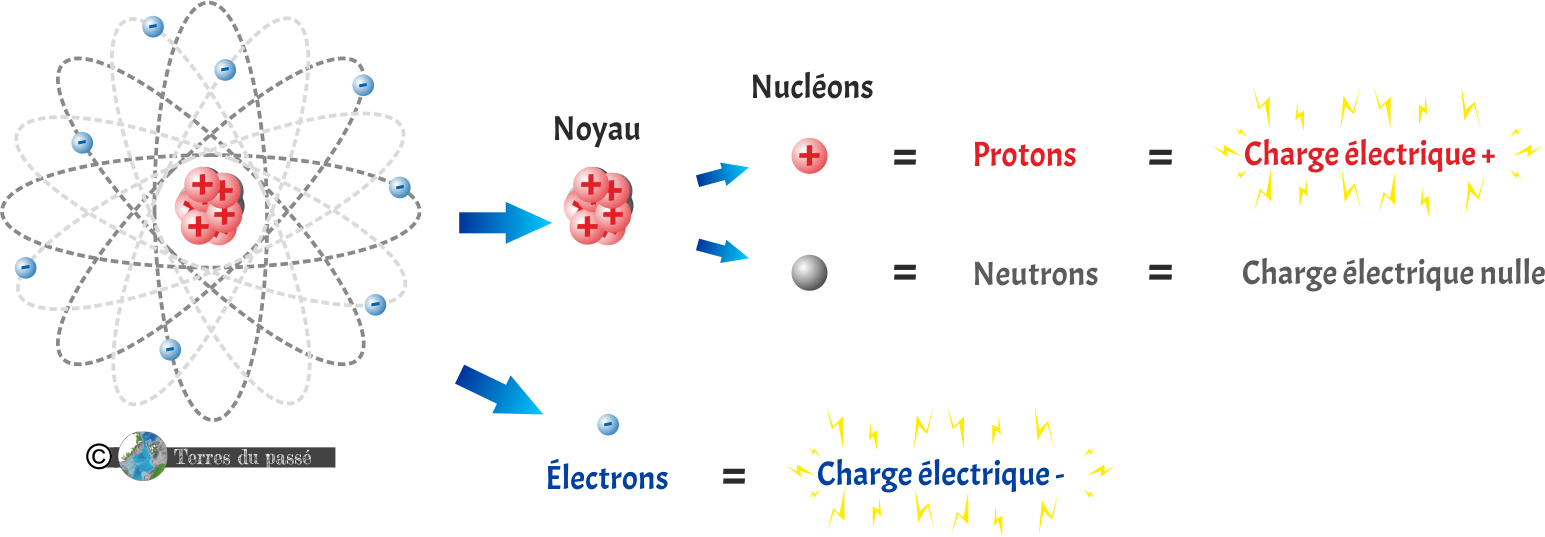
L'atome est le constituant fondamental de la matière !
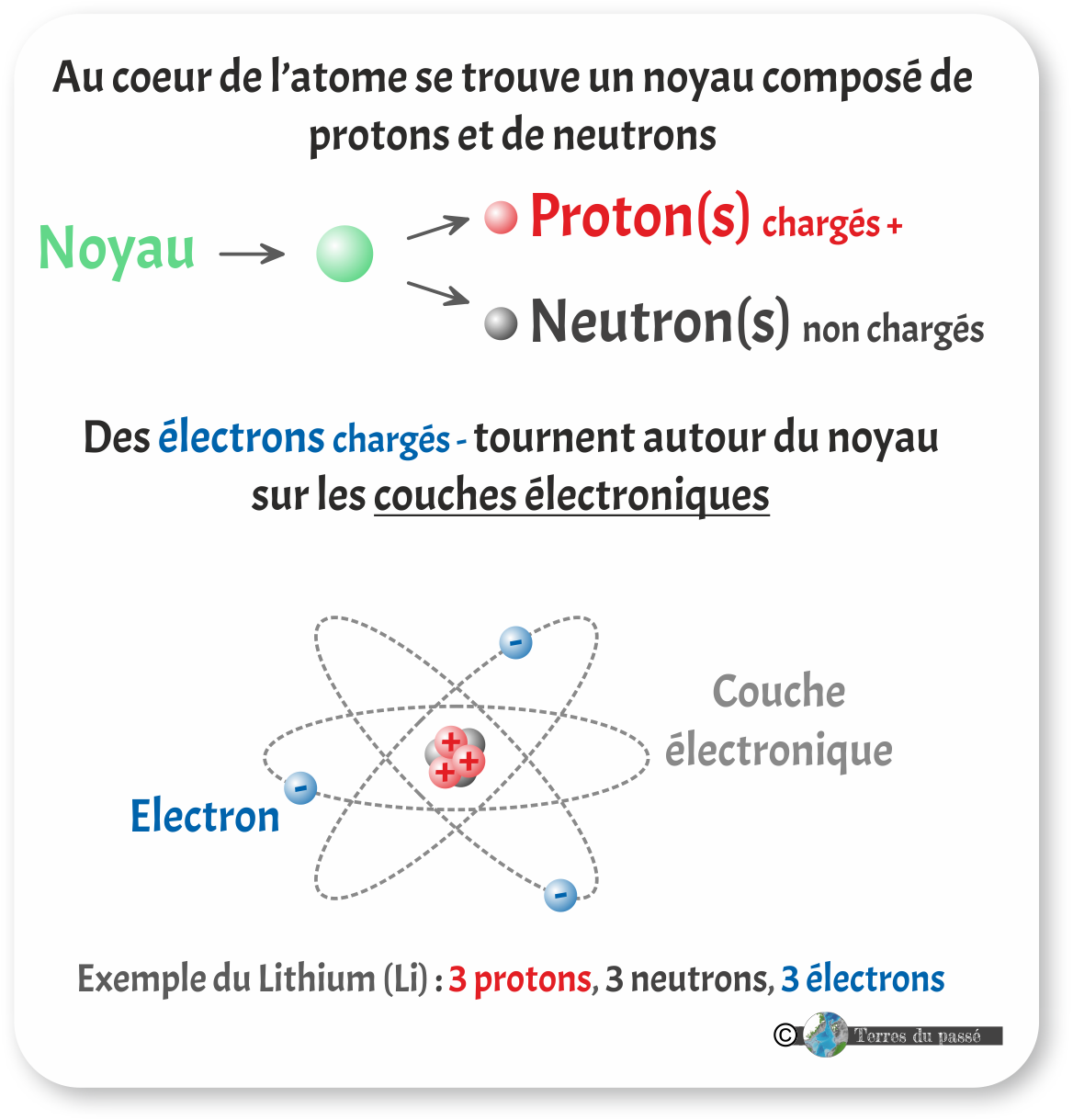
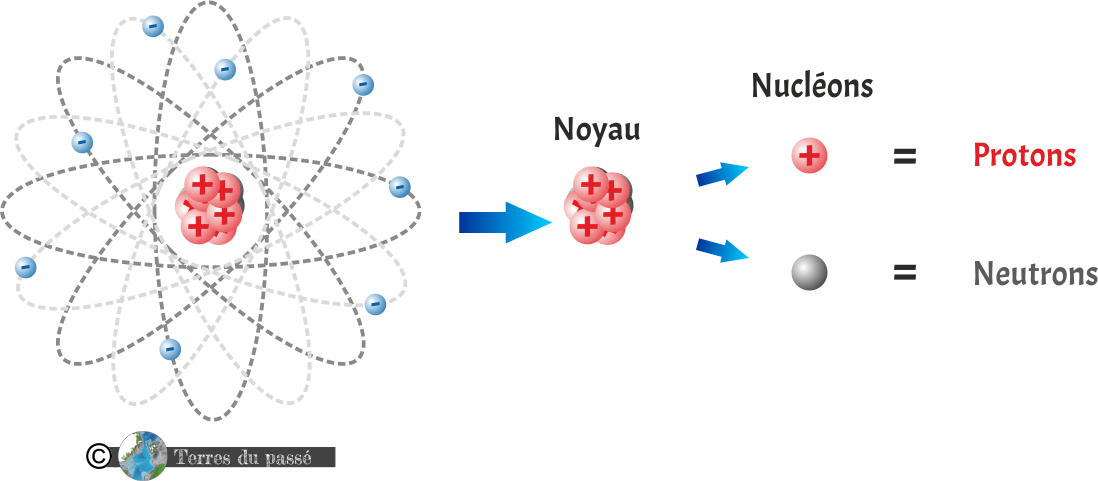
Il se compose d'un noyau dans lequel se trouve des nucléons.
Les nucléons sont donc des particules du noyau : les protons et de neutrons.
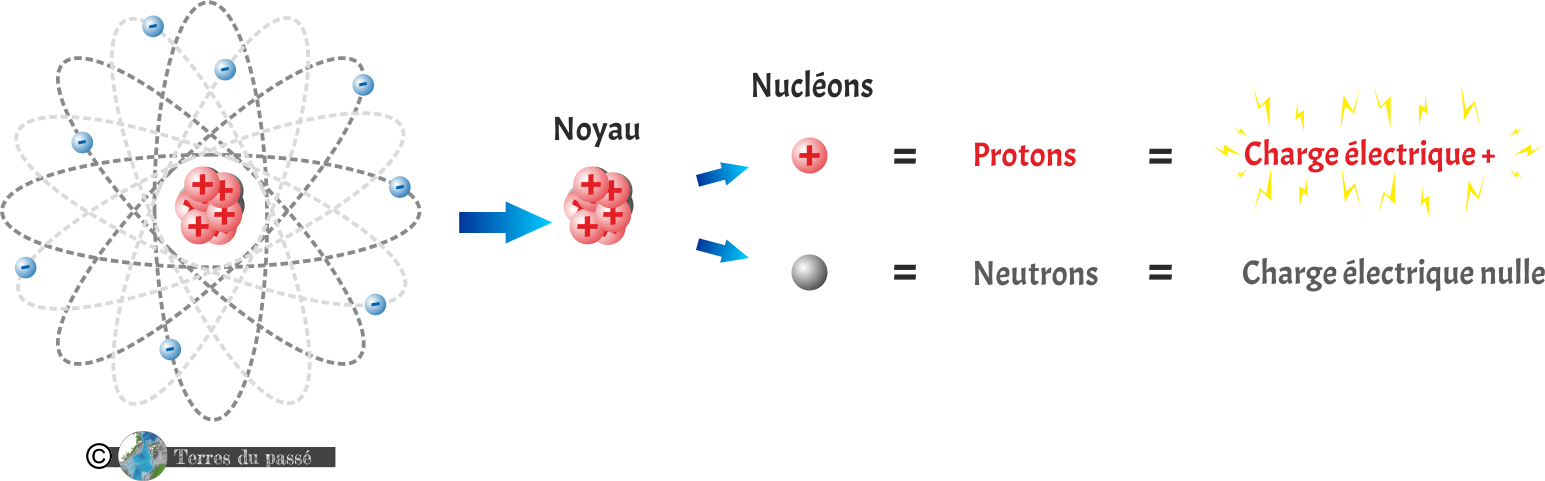
Les protons sont des particules subatomiques (plus petites que l'atome) portant une charge électrique positive (+).
Les neutrons sont des particules subatomiques portant une charge électrique nulle.
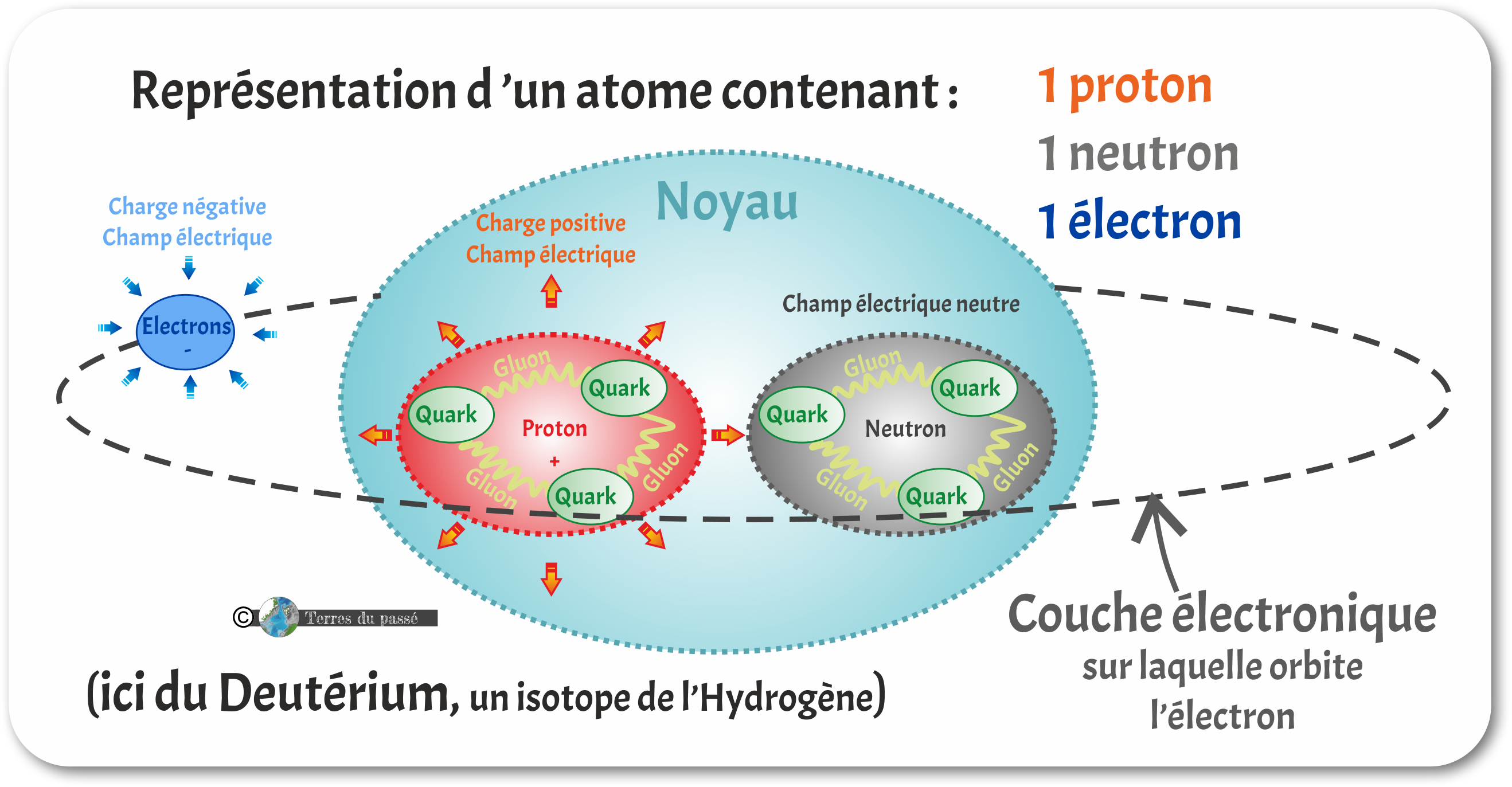
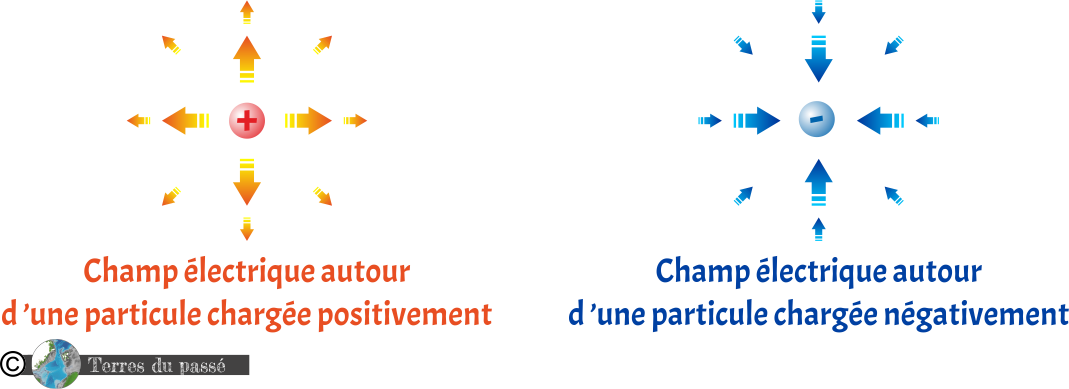
La charge électrique permet à la matière d'interagir par l'intermédiaire de champs électromagnétiques. Les charges électriques peuvent être soit positives, soit négatives. Elles produisent alors un champ électrique que l'on représente (par convention) inverse l'une par rapport à l'autre. Les particules portant une charge électrique positive (comme les protons) ont un champ électrique que l'on représente orienté vers l'extérieur. Les particules portant une charge électrique négative (comme les électrons) ont un champ électrique que l'on représente orienté vers l'intérieur (note : cette convention sur les sens des champs électriques permet qu'une charge électrique positive aille toujours vers une charge électrique négative).
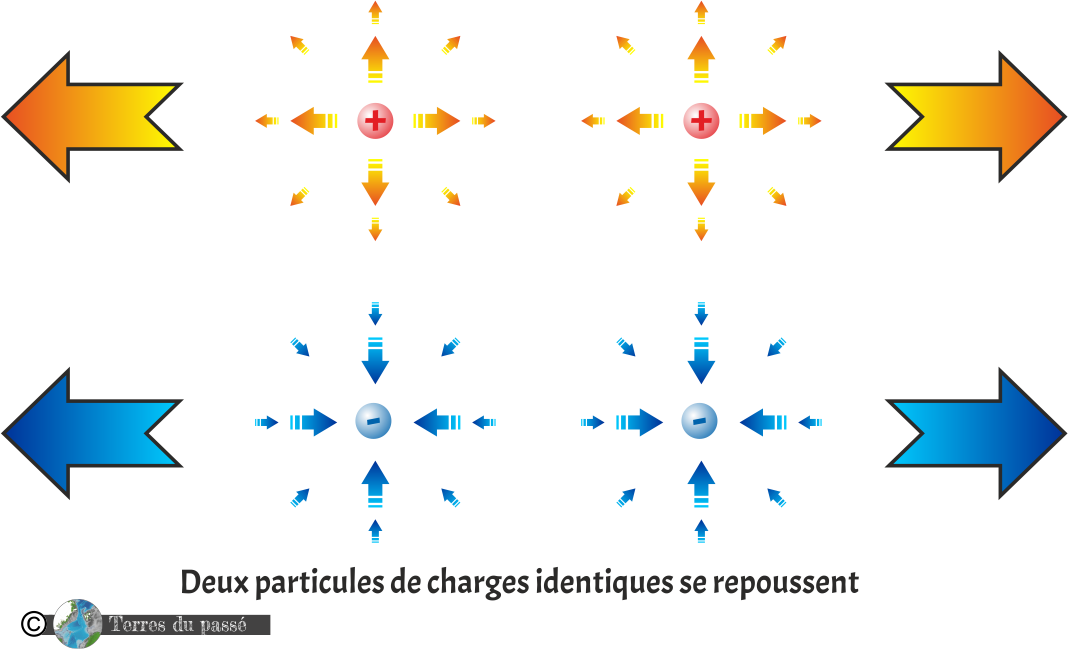
Deux particules de même charge se repoussent :
Tandis que deux particules de charges opposées s'attirent, ce qui leur permet de créer des interactions électromagnétiques :
Autour du noyau de l'atome orbitent des électrons. Ce sont des particules subatomiques portant une charge électrique négative (-).
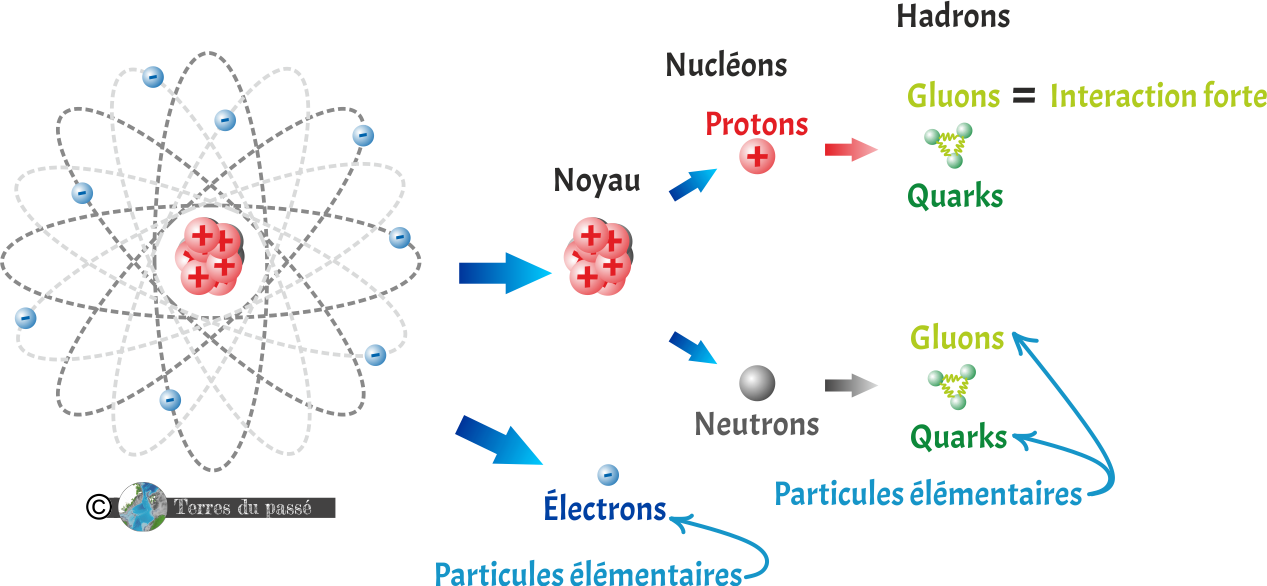
Les électrons sont des particules élémentaires (n'étant pas composées d'autres particules plus petites) alors que les protons et les neutrons sont des particules composites composées de trois particules plus petites, les hadrons (trois quarks, liées par des gluons).
Les électrons se répartissent autour du noyau sur des niveaux d'énergie appelés des couches électroniques. Nous y reviendrons dans la un peu plus tard.
En résumé
Qu'est-ce qu'un élément chimique ?
C'est un atome caractérisé par un nombre défini de protons dans le noyau.
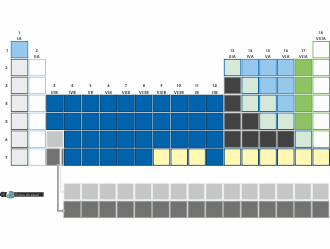
L'ensemble des éléments chimiques connus est regroupé dans le tableau de Mendeleïev, aussi appelé le tableau périodique des éléments chimiques. Ce tableau, un peu complexe de prime abord, apporte énormément d'informations sur les éléments chimiques et leurs propriétés physiques.
Alors, à vue de nez, ça ne semble vraiment pas évident... Il y a des couleurs de partout, de petits symboles, des encadrés en traits pleins ou en pointillés, des chiffres dans tous les sens, des lignes qui sortent du tableau.... Bref, un beau bazar !
Pour bien comprendre, il faut prendre le temps de décortiquer les différents éléments. Et vous allez voir, quand on prend les choses les unes après les autres, tout devient clair ! Ou presque...
- Dans la Partie 1, vous trouverez l'explication du format des cases du tableau.
- Dans la Partie 2, vous aurez une explication détaillée sur le contenu de chaque case.
- Dans la Partie 3, vous découvrirez la signification des lignes et des colonnes du tableau.
Ces trois premières parties sont suffisantes pour comprendre le tableau périodique, son utilité, et en tirer beaucoup d'informations. À partir de la Partie 4, les choses se complexifient un peu : nous commençons à aborder des notions quantiques. De nombreuses images illustrent ces notions un peu plus complexes afin de les rendre le plus visuel possible. N'hésitez pas à envoyer vos commentaires par l'intermédiaire du formulaire de contact que vous trouverez ici !
- Dans la Partie 4, vous verrez en détails à quoi correspondent les familles chimiques du tableau périodique (les colonnes).
- Dans la Partie 5, vous apprendrez le fonctionnement du remplissage des couches électroniques en fonction des périodes (les lignes).
- Dans la Partie 6, vous découvrirez comment s'édifie le cortège électronique autour des atomes.
Vous trouverez toutes les fiches de synthèse portant sur le tableau périodique sur cette page.
 Chimie
Chimie
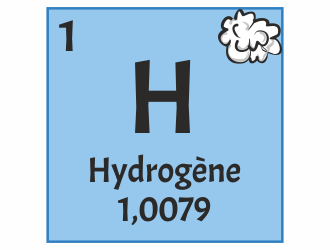
Comprendre le tableau périodique - Partie 1 - De la forme au contenu
 Chimie
Chimie
Comprendre le tableau périodique - Partie 2 - Le contenu des cases
Comprendre le tableau périodique - Partie 3 - Les lignes et les colonnes
Comprendre le tableau périodique - Partie 4 - Les familles chimiques
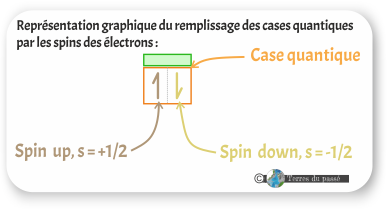
Comprendre le tableau périodique des éléments - Partie 5 - Nombres quantiques et couches électroniques
 Chimie
Chimie
Comprendre le tableau périodique - Partie 6 - Edification du cortège électronique
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans
.png)
.png)
.png)