Composition de l'eau de mer
Composition de l'eau de mer

Cas de l'eau de mer standard
Certains composés chimiques de l'eau de mer sont dits majeurs parce que très abondants, ce qui veut dire que leur concentration est supérieure à 1 mg/L. Ces éléments ont des proportionnalités constantes, c'est pourquoi ils entrent dans la compositions de l'eau de mer standard.
D'autres sont mineurs, ce qui signifie qu'ils ne sont présents qu'en quantités infimes.
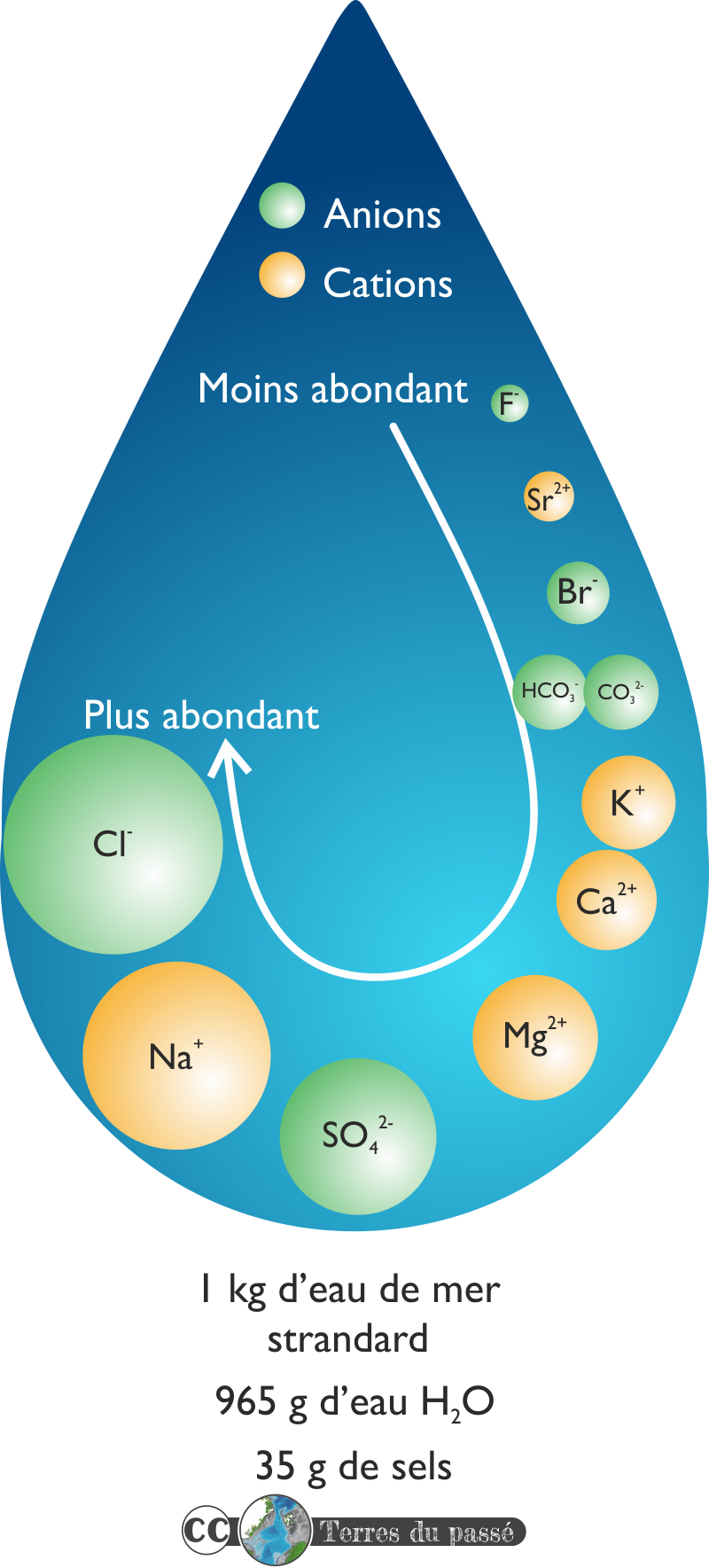
Les éléments majeurs sont au nombre de dix, cinq cations et cinq anions et forment ce que l'on appelle des sels :
- Cations :
- Sodium, Na+ : 10,77 g/kg soit 0,4685 mol/kg.
- Magnésium, Mg2+ : 1,29 g/kg soit 0,05308 mol/kg.
- Calcium, Ca2+ : 0,4121 g/kg soit 0,01028 mol/kg.
- Potassium, K+ : 0,399 g/kg soit 0,01021 mol/kg.
- Strontium, Sr2+ : 0,0079 g/kg soit 9x10-5 mol/kg.
- Anions :
- Chlorure, Cl- : 19,354 g/kg soit 0,54591 mol/kg.
- Sulfate, SO42- : 2,712 g/kg soit 0,02823 mol/kg.
- Bicarbonate + carbonate, HCO3- + CO32- : 0,140 g/kg soit 0,0023 mol/kg.
- Bromure, Br- : 0,0673 g/kg soit 8,42x10-4 mol/kg.
- Fluorure, F- : 0,0013 g/kg soit 7x10-5 mol/kg.
Bien entendu, l'élément majeur de l'eau de mer est l'eau H2O, à raison de 965 g/kg.
Tout ce que nous venons de dire peut se résumer dans la phrase suivante :
Pour 1 kg d'eau de mer standard, il y a 965 g d'eau et 35 g de sels.
En regardant cette composition en détails, il est possible de se rendre compte que le sodium (Na+) et le chlorure (Cl-) sont les deux sels les plus abondants. Ils vont s'associer pour former du NaCl, le sel que l'on utilise dans nos plats.
Sur les 35 g de sels présents dans l'eau de mer, 30 g correspondent au NaCl et 4 g correspondent au sulfate de magnésium, MgSO4. Le gramme de sels restant correspond à la somme des autres éléments.
Les éléments constitutifs du carbone n'entrent pas dans la composition de l'eau de mer standard car ce sont des éléments à concentration variable, contrairement à ces sels.
La salinité de l'eau de mer est-elle la même partout dans les océans du monde ?
Non, la salinité n'est pas constante en tous points. Certaines mers intérieures ont une salinité bien supérieure à celle de l'eau de mer moyenne. D'autres endroits présentent une salinité plus faible. Présentons quelques exemples :
- La mer Méditerranée a une salinité supérieure à la moyenne, comprise entre 37 et 39 g/kg d'eau.
- La mer Rouge également, avec une salinité autour de 40 g/kg d'eau.
- L'Arctique, en revanche, reçoit de l'eau douce par les fleuves russes et canadiens et ne subit que peu d'évaporation. Ce bassin océanique présente donc une salinité globalement inférieure à la moyenne, autour de 32 g/kg. Mais ce bassin connaît des conditions particulières que nous verrons plus en détails dans les chapitres lui étant dédiés.
Les mers Rouge et Méditerranée présentent des salinités plus élevées que la moyenne car elles subissent plus d'évaporation qu'elles ne reçoivent d'eau douce.
La différence entre les bassins océaniques est marquée par la gamme de salinité, comprise entre 32 et 40 g/kg. Et cette différence de salinité s'explique par le bilan d'évaporation et d'apports en eau douce. La quantité d'eau varie entre les différents bassins, ce qui explique la plus ou moins grande dilution des sels. Ce phénomène s'explique par la loi de Dittmar qui stipule que le rapport de concentration entre les éléments majeurs est constant indépendamment de la quantité d'eau.
En clair, peu importe la quantité d'eau, la quantité de sels reste la même.
Expliquons-le autrement : cela revient à prendre deux verres de sirop de fraise : on met une mesure de sirop dans chaque verre (ce sont nos sels) et soit on remplit le verre à moitié avec de l'eau (c'est la Méditerranée), soit on le remplit jusqu'au bord avec de l'eau (c'est l'Arctique). La quantité de sirop (donc de sels) est la même dans les deux verres (donc dans les deux mers) mais la concentration du sirop (donc de sels) dans le premier verre (donc dans la Méditarranée) est plus importante que dans l'autre (donc dans l'Arctique) parce que la quantité d'eau n'est pas la même.
C'est très simplifié mais ça permet de visualiser un peu mieux le principe.
Ensuite, la circulation océanique, les courants marins, permettent de mélanger ces masses d'eau de salinités différentes.
Comportement des éléments chimiques dissous
Les éléments chimiques peuvent adopter plusieurs comportements dans les océans. Il y a :
- Les éléments conservatifs,
- Les éléments recyclés,
- Les éléments adsorbés,
- Les gaz dissous.
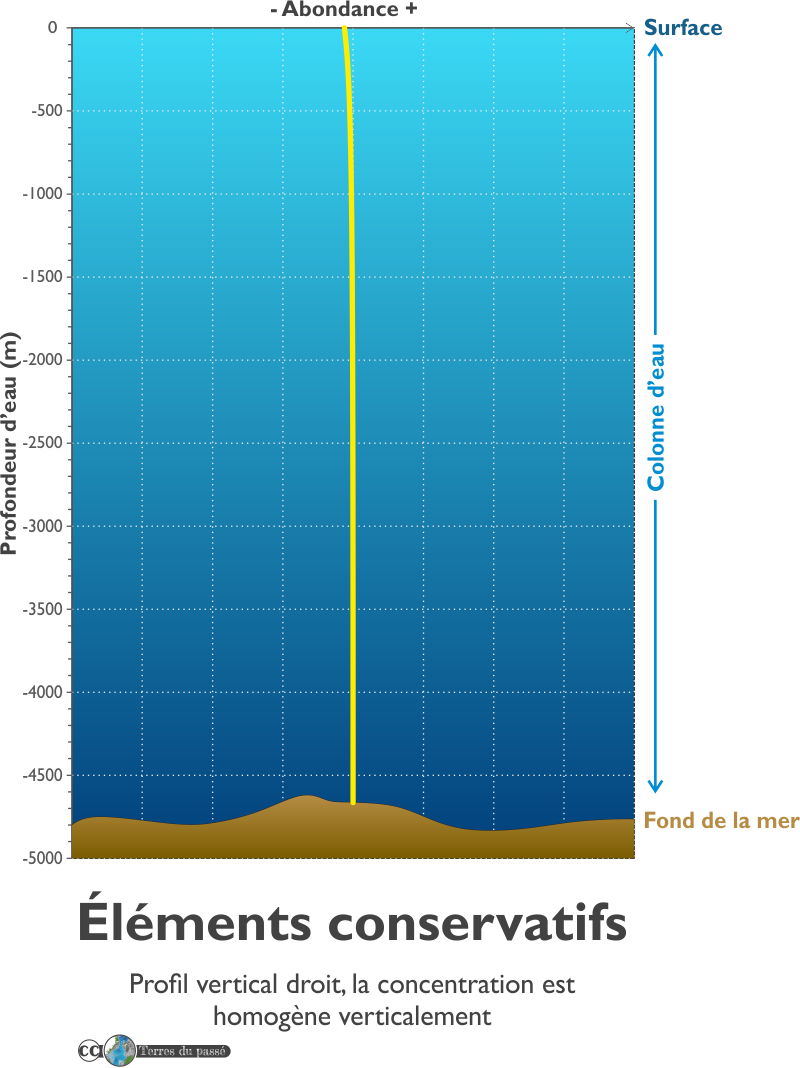
Les éléments conservatifs
Les éléments conservatifs ont un profil vertical droit, ce qui signifie que leur concentration est homogène verticalement.
Ce type de comportement est adopté par les éléments suivant la loi de Dittmar, donc les éléments majeurs cités ci-dessus mais aussi quelques éléments traces, tels que l'Uranium.
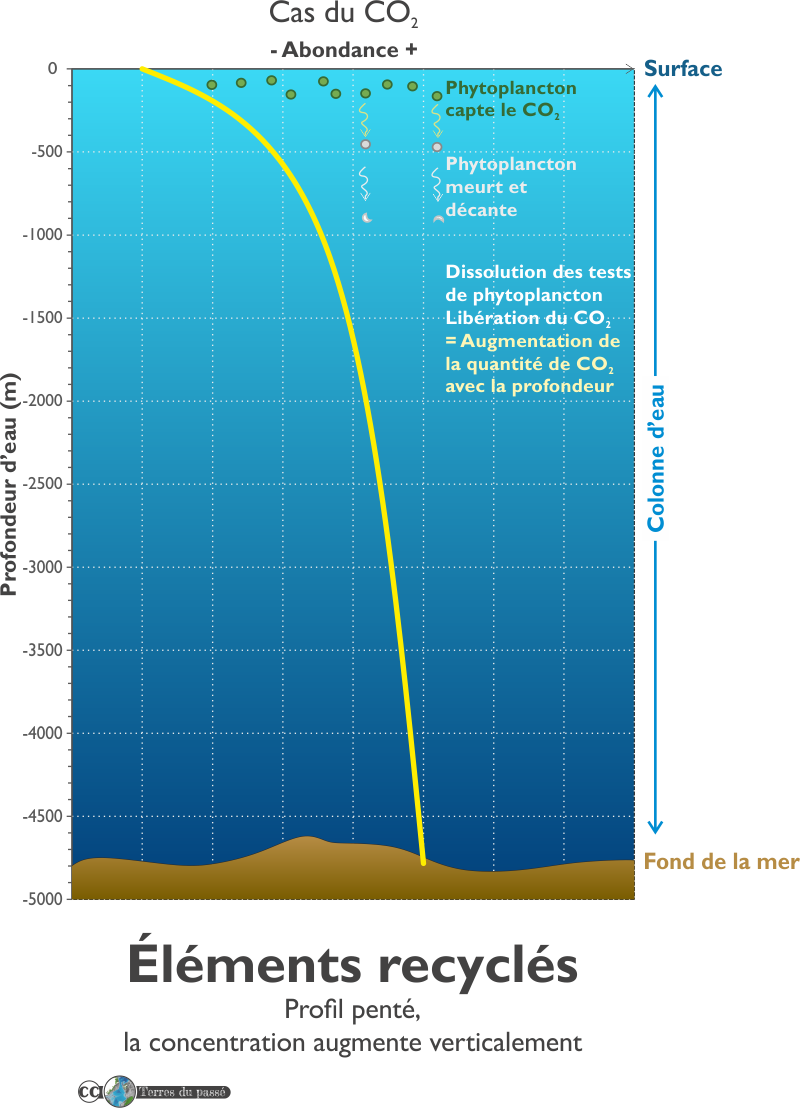
Les éléments recyclés
Les éléments recyclés ont un profil vertical montrant une augmentation de leur concentration avec la profondeur.
Les éléments présentant ce type de profil (cela comprend le carbone, l'azote, le phosphore, le silicium, etc.) s'associent en surface avec des particules qui, en profondeur, se dissolvent. En se dissolvant, elles libèrent ces éléments dans la colonne d'eau, ce qui fait augmenter leur concentration dissoute. Ce sont systématiquement les éléments chimiques liés à la vie océanique : le zooplancton, le phytoplancton, etc.
La production primaire se produit dans la zone photique de l'océan. Sous la zone photique, il n'y a plus de production primaire. Ce sont les organismes hétérotrophes qui dominent le milieu, soit ceux qui consomment de la matière organique pour produire la-leur.
Les concentrations des éléments chimiques ainsi relargués lors de la dissolution des microorganismes augmentent rapidement sous la zone photique mais une fois en grande profondeur, leurs concentrations évoluent très peu car il y beaucoup moins d'organismes.
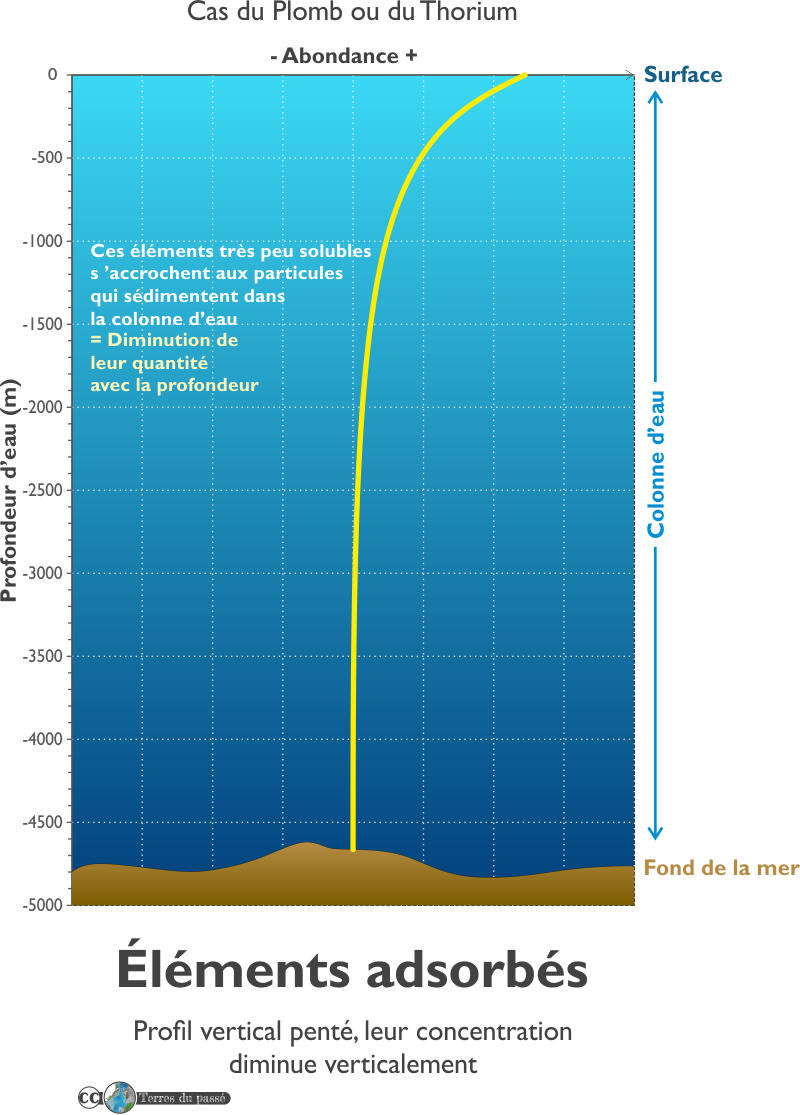
Les éléments adsorbés (scavenged elements en anglais)
Certains éléments chimiques présentent un profil penté décroissant : leur concentration diminue avec la profondeur.
Ces éléments chimiques s'accrochent aux particules durant la décantation dans la colonne d'eau, les faisant passer à l'état particulaire, puis ils s'accumulent sur le fond par sédimentation.
Les gaz dissous
Les gaz dissous ont des propriétés particulières : ce sont les composés atmosphériques dont la concentration dissoute est régie par ce qui se trouve dans l'atmosphère. Leur comportement est donc dépendant de l'atmosphère.
Ces gaz suivent la loi de Henry. Cette loi stipule que plus l'eau est froide et douce, plus les gaz sont solubles.
Dans le cas du dioxygène dissous, O2, à l'équilibre avec l'atmosphère, le maximum d'O2 dissous (cO2(aq) = 450 µmol/L) est atteint dans une eau à 0°C et de salinité 0.
En revanche, dans une eau chaude et salée, comme dans le cas de la mer Rouge où la température de surface de la mer (SST pour Sea Surface Temperature) avoisine 30°C et où la salinité (S) atteint 40 g/L, la concentration de dioxygène dissous cO2(aq) = 180 µmol/L.
Ces éléments sont importants pour connaître les échanges qui se font entre l'atmosphère et l'océan. Prenons l'exemple d'une eau saturée en dioxygène dissous : la concentration en O2 est à l'équilibre entre la surface de l'océan et l'atmosphère, il n'y a donc pas d'échange.
Puis la photosynthèse commence. Comme le milieu est saturé, le dioxygène O2 produit par le phytoplancton n'a "plus la place" de s'accumuler dans l'eau : l'O2 part vers l'atmosphère. Il y a donc un enrichissement de l'atmosphère en dioxygène.
Ce phénomène joue également sur le CO2 : lorsque la photosynthèse se produit, elle consomme beaucoup de CO2. La surface de l'océan n'est alors plus à l'équilibre avec l'atmosphère au-dessus : il y a un déficit de CO2 dans l'eau car il est consommé par le phytoplancton. L'atmosphère transfère donc du CO2 gazeux à l'océan pour retrouver un état d'équilibre. Tant que la photosynthèse perdure, la surface n'est pas à l'équilibre et l'océan continue de pomper du CO2 gazeux à l'atmosphère.
Ce phénomène est une pompe à carbone naturelle : il y a consommation du CO2 atmopshérique par les microorganismes phytoplanctoniques, mais ils ne consomment pas directement le CO2 de l'atmosphère. C'est le besoin d'équilibre entre l'océan et l'atmosphère qui induit un transfert de CO2 gazeux vers la mer et qui permet ainsi aux microorganismes de l'utiliser. C'est un équilibre thermodynamique.
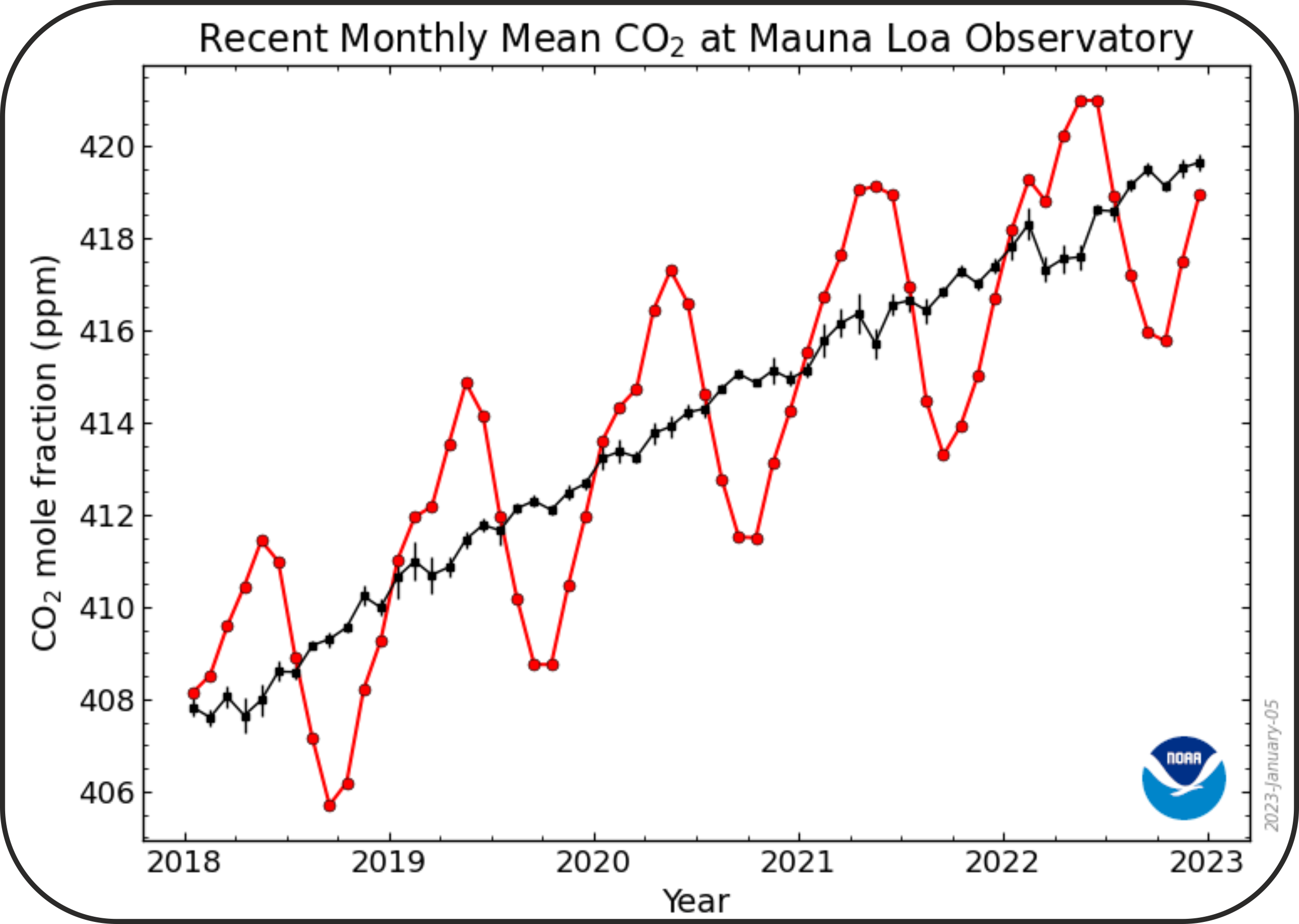
La nuit tombée, la photosynthèse s'arrête et la consommation de la matière organique, consommatrice de dioxygène et relarguant du CO2, se produit. C'est ce même phénomène qui est enregistré sur les données de CO2 atmopshérique de Mauna Loa, à Hawaï, mais à l'échelle des saisons :
La courbe rouge présente des vagues correspondant en fait à l'augmentation de la consommation du CO2 atmosphérique durant le printemps, avec les blooms phytoplanctoniques, puis à l'hiver, avec la dominance de la consommation de matière organique par les organismes hétérotrophes et donc le relargage de CO2.
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans