 Comprendre le tableau périodique - Partie 5 - Nombres quantiques et couches électroniques
Comprendre le tableau périodique - Partie 5 - Nombres quantiques et couches électroniques
Bonjour et Bienvenue !
Ce qui va suivre est un petit peu compliqué et pointu, mais particulièrement utile pour comprendre plus en détails aussi bien le remplissage du tableau périodique, que la façon dans les atomes vont créer des liaisons entre eux pour s'assembler en molécules.
Nous allons également voir quelques isotopes, dont certains radioactifs, et détailler ensemble les phénomènes de décroissance radioactive qui se produisent dans la nature, mais aussi dans les centrales nucléaires. Nous resterons toujours dans une science très imagée, et avec un minimum de formules : ces quelques pages n'ont pas vocation de présenter un cours de chimie de niveau universitaire, mais bien de permettre à tout un chacun de pouvoir aller un peu plus loin et comprendre un peu mieux les fondamentaux de chimie.
Dans la partie références bibliographiques en bas de cette page, vous trouverez plusieurs sites internets et livres à consulter pour aller plus loin.
Les nombres quantiques, les couches électroniques et les orbitales atomiques
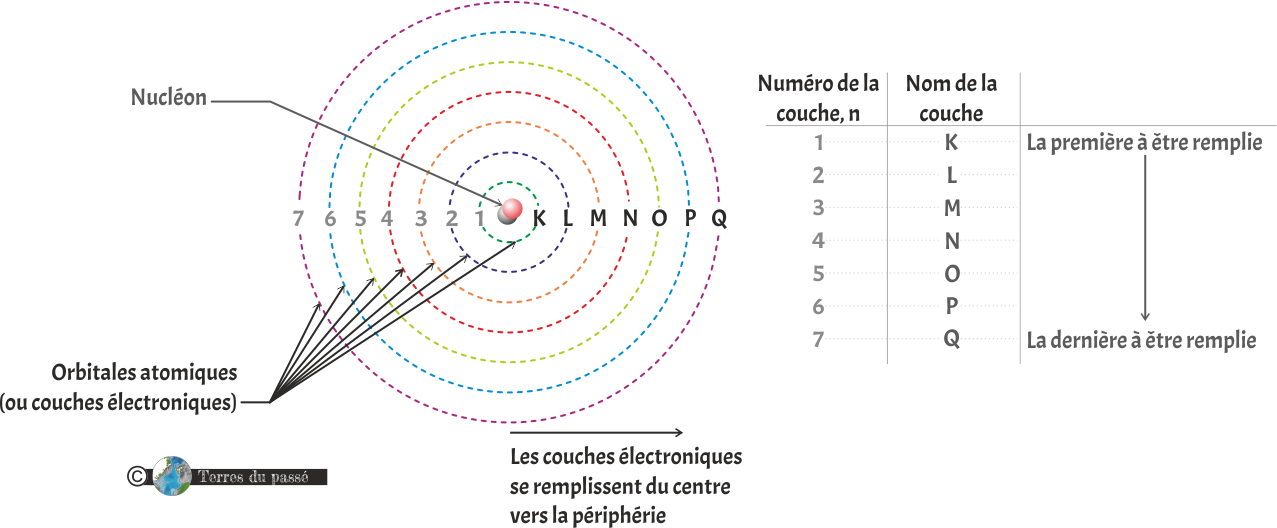
Les électrons tournent autour du noyau de l'atome. Plus il y a d'électrons, plus le nuage électronique est étendu. Les couches s'arrangent depuis le centre vers l'extérieur comme présenté ci-dessous :
Représentation des couches électroniques des atomes. Cette représentation correspond au modèle de l'atome de Bohr. Les atomes étant beaucoup trop petits pour pouvoir être "vus", ce modèle est une visualisation schématique de la structure atomique.
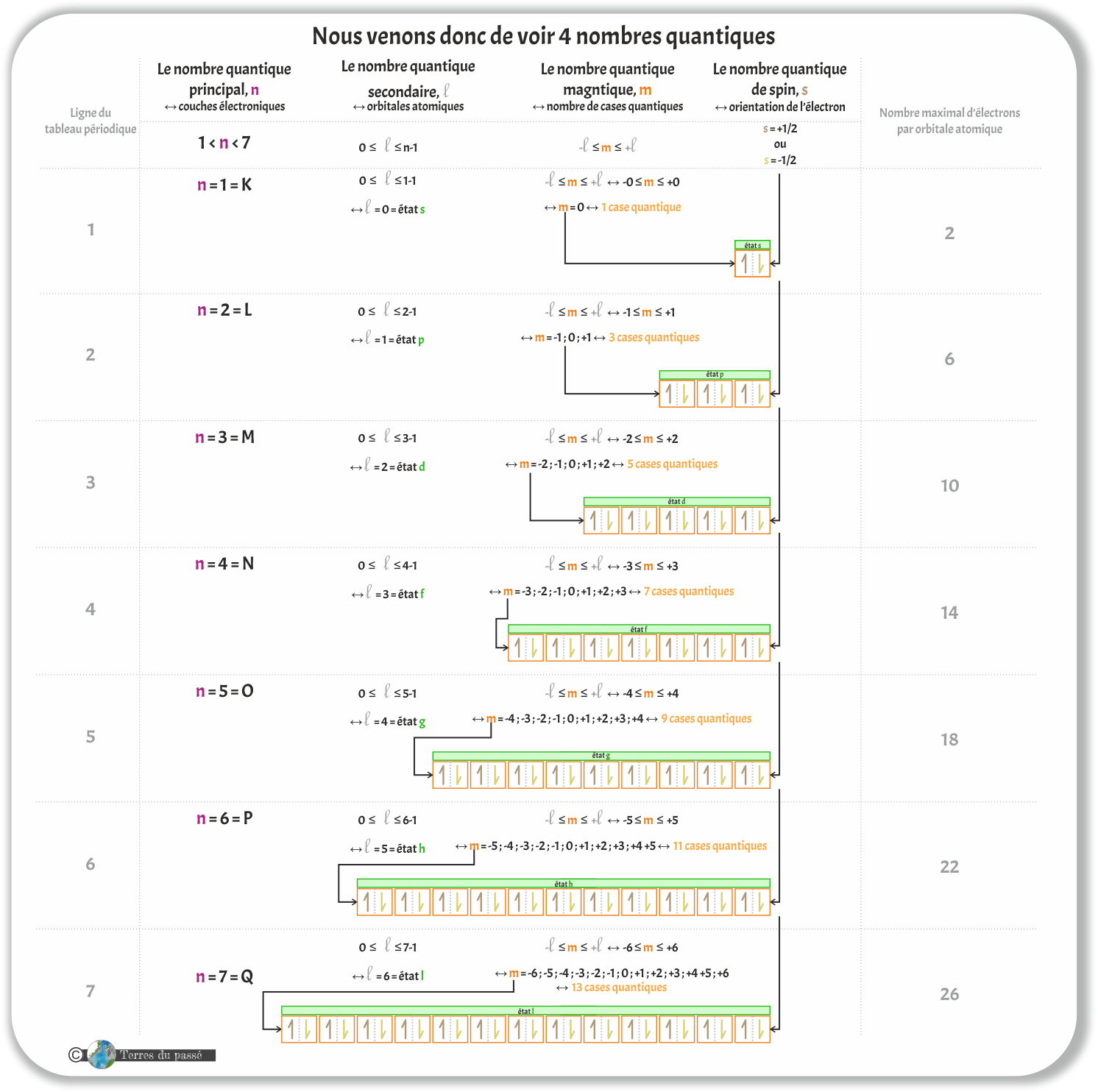
Les couches électroniques sont définies par un nombre entier, appelé le nombre quantique principal, noté n = 1, 2, 3... Chaque nombre quantique principal est associé à une lettre, notée K, L, M... Chaque couche électronique a la capacité de contenir un nombre défini d'électrons :
- La couche n = 1 = K peut contenir 2 électrons.
- La couche n = 2 = L peut contenir 8 électrons.
- La couche n = 3 = M peut contenir 18 électrons.
- La couche n = 4 = N peut contenir 32 électrons.
- La couche n = 5 =O peut contenir 50 électrons.
- La couche n = 6 = P peut contenir 72 électrons.
- La couche n = 7 = Q peut contenir 98 électrons.
Chaque couche se remplit progressivement depuis le centre vers la périphérie.
Ensuite, il y a le nombre quantique secondaire appelé l. Ce nombre est un entier, fixé par n tel que : 0 ≤ l ≤ n-1.
Si n correspond aux couches électroniques, l correspond à des sous-couches électroniques, que nous appellerons orbitales atomiques.
Par exemple, si n = 3 = M, alors l est compris entre 0 ≤ l ≤ n-1 ⇔ 0 ≤ l ≤ 3-1 ⇔ 0 ≤ l ≤ 2
Cela singifie que l peut avoir trois valeur :
- l = 0
- l = 1
- l = 2
Ces valeurs de l définissent un état. Comme pour n, les différentes valeurs de l possibles sont associées à des lettres :
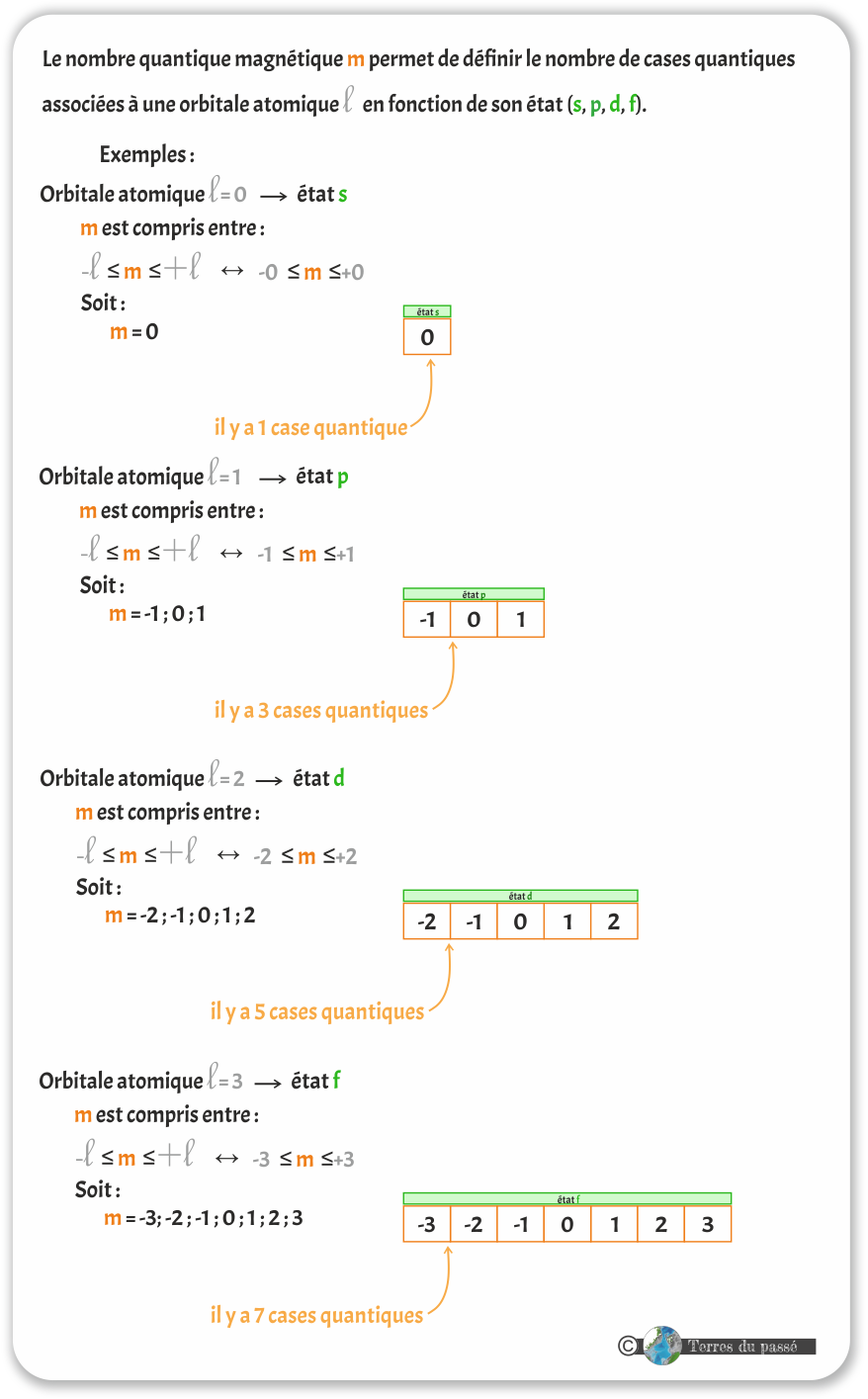
- Orbitale atomique l = 0 est l'état s
- Orbitale atomique l = 1 est l'état p
- Orbitale atomique l = 2 est l'état d
- Orbitale atomique l = 3 est l'état f
Il existe un troisième nombre quantique : le nombre quantique magnétique, noté m. Ce nombre est plus historique que réel. Il correspond au nombre quantique principal n, mais n'est utilisé que lorsque des champs magnétiques sont en jeu. Il est alors associé à la notion de cases quantiques.
Le nombre quantique magnétique se définit tel que : -l ≤ m ≤ +l
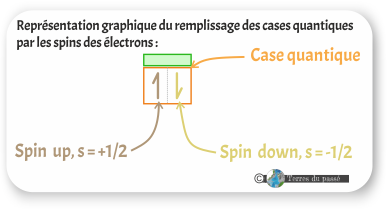
Il reste à voir le nombre quantique de spin, noté s. En anglais, spin signifie tourner : c'est un nombre quantique pour les électrons. Il ne peut avoir que deux valeurs : -1/2 ou +1/2. Chaque case quantique peut contenir deux électrons qui vont s'agencer suivant leur spin :
- soit up (vers le haut) pour le spin s = +1/2
- soit down (vers le bas) pour le spin s = -1/2
Une demie flèche de spin (comme représenté ci-dessus) correspond à un électron.
Tout ce que nous venons de voir peut être synthétisé dans le tableau ci-dessous :
Ce chapitre aborde des notions complexes de chimie quantique. Comprendre les notions de couches électroniques, d'orbitales atomiques, d'états quantiques, de cases quantiques et de spin des électrons n'est pas une mince affaire. Bravo d'être arrivé jusqu'ici !
À présent, il nous faut nous pencher sur la question de l'édification du cortège électronique des atomes. Alors, prenons un peu d'élan et filons comme des étoiles à la découverte de la règle de Klechkowski !
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans
.png)