 Les minéraux silicatés
Les minéraux silicatés

Les silicates de la croûte
La croûte est composée chimiquement d’oxygène (O) à 46,6%, de silice (Si) à 27,7%, d’aluminium (Al) à 8,1%, de fer (Fe) à 5%, de calcium (Ca) à 3,6%, de sodium (Na) à 2,8%, de potassium (K) à 2,6% et de magnésium (Mg) à 2,1%.
Ces 8 éléments à eux seuls composent 98,5% de éléments chimiques de la croûte.
Dans ce chapitre, nous allons nous intéresser aux deux principaux : l’oxygène et le silicium, qui représentent presque 75% de la composition de la croûte à eux seuls. En effet, ces deux éléments sont à la base des silicates, minéraux de base composant la croûte.
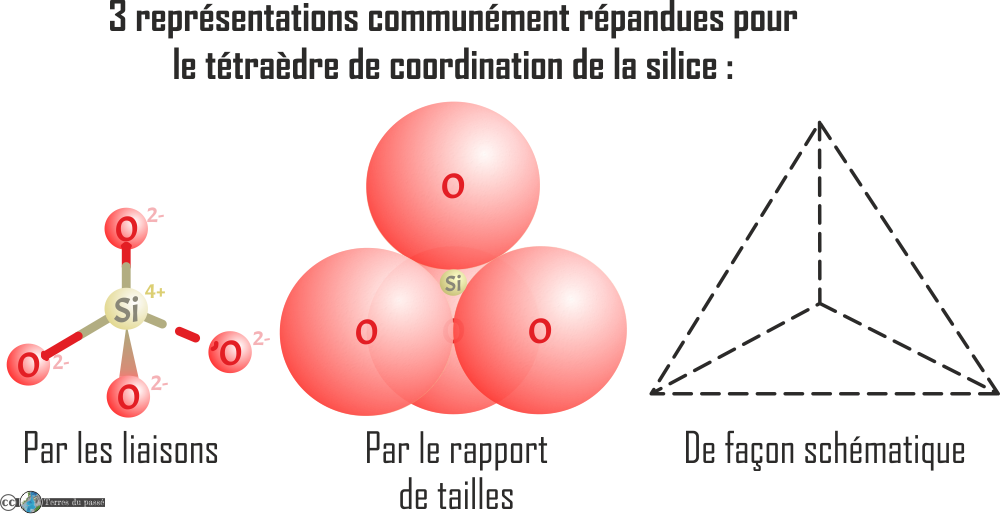
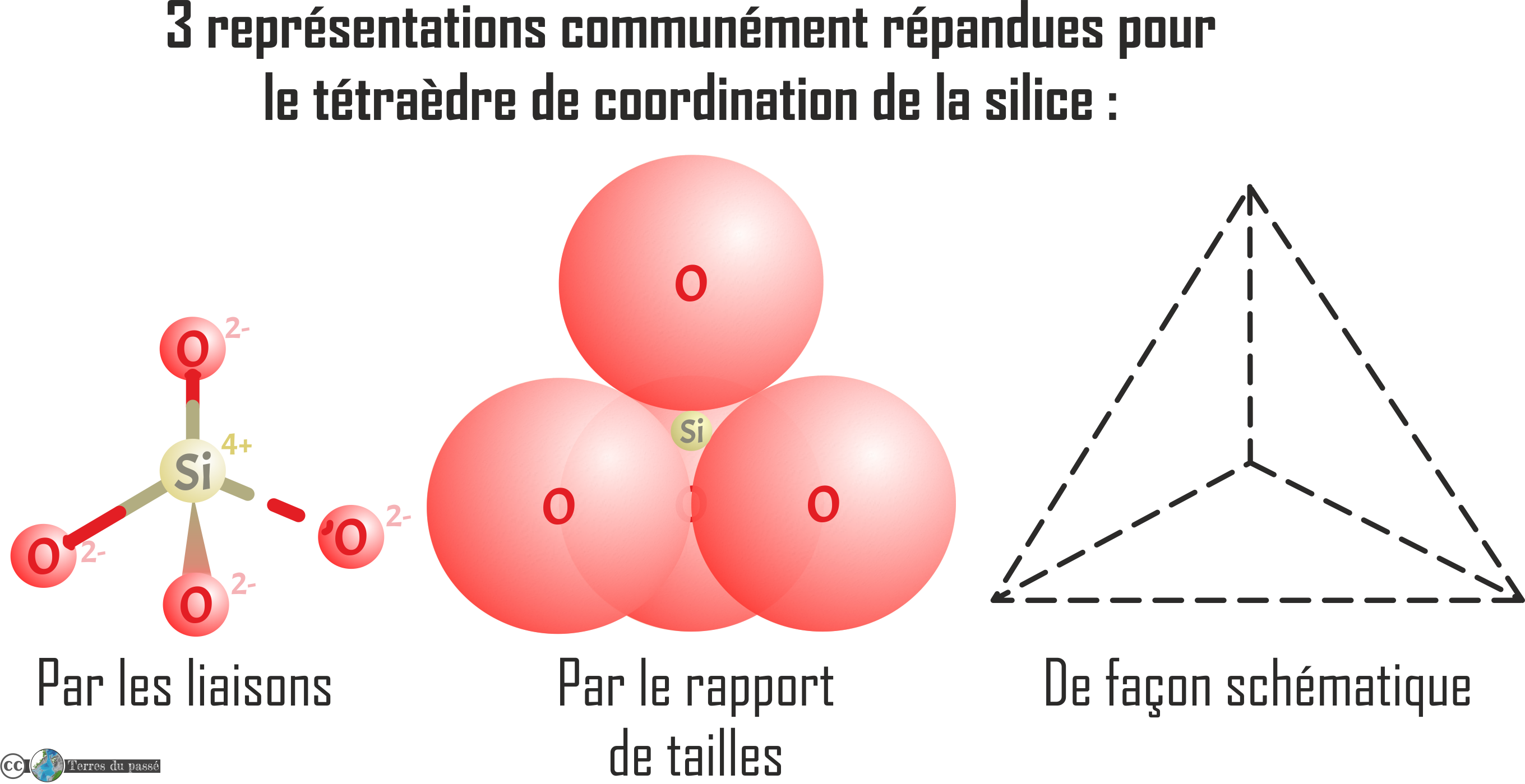
Les silicates ont une structure de base en tétraèdre, c'est ce qu'on appelle le polyèdre de coordination. Il comprend un cation de silicium au centre : le Si4+, entouré par quatre anions d'oxygène O2-. Il y a trois représentation majoritairement utilisées pour ce polyèdre :
Cette brique élémentaire n’est pas équilibrée (4 (+) pour 8 (-), soit une charge résultante négative -4). Il faut donc rajouter des cations pour mettre cette molécule à l'équilibre. Ce sont en fait ces cations supplémentaires s'imbriquant dans la molécule de (SiO4)4- qui finissent de constituer les roches de la croûte.
La diversité des silicates
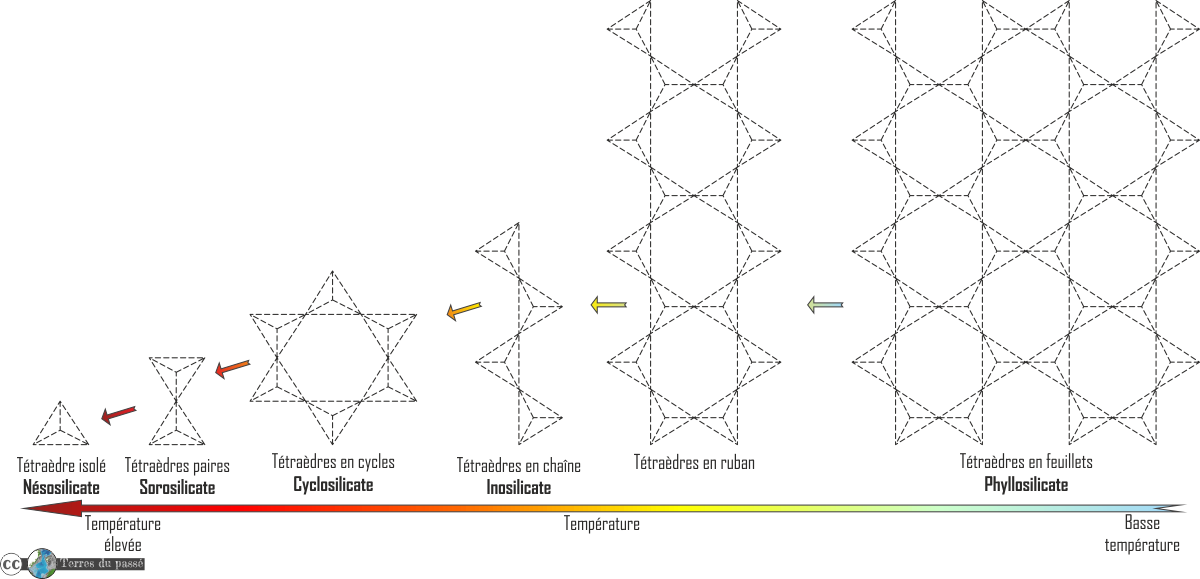
À partir de maintenant, nous allons essentiellement utiliser le mode de représentation schématique pour décrire la diversité des silicates. La polymérisation des tétraèdres revient à accrocher deux tétraèdres par les oxygènes. Globalement, au cours de la polymérisation, comme des oxygènes en commun sont ajoutés, cela induit une augmentation de la quantité de silicium par rapport à celle des oxygènes :
La polymérisation se fait en fonction de la température.
La loi est simple : plus la température est faible, plus le degré de polymérisation est élevé.
À température élevée, il y a peu de polymérisation. Quand la température décroît, on a de plus en plus de polymérisation jusqu’au tectosilicate.
Le magma, une fois émis, refroidit. La température décroît, ce qui polymérise les silicates, formant des minéraux silicatés différents au fur et à mesure de la baisse de température. Et ceci toujours à partir du petit tétraèdre. Entre chaque catégorie de silicate, il y a une augmentation de la polymérisation.
Ainsi, on retrouve :
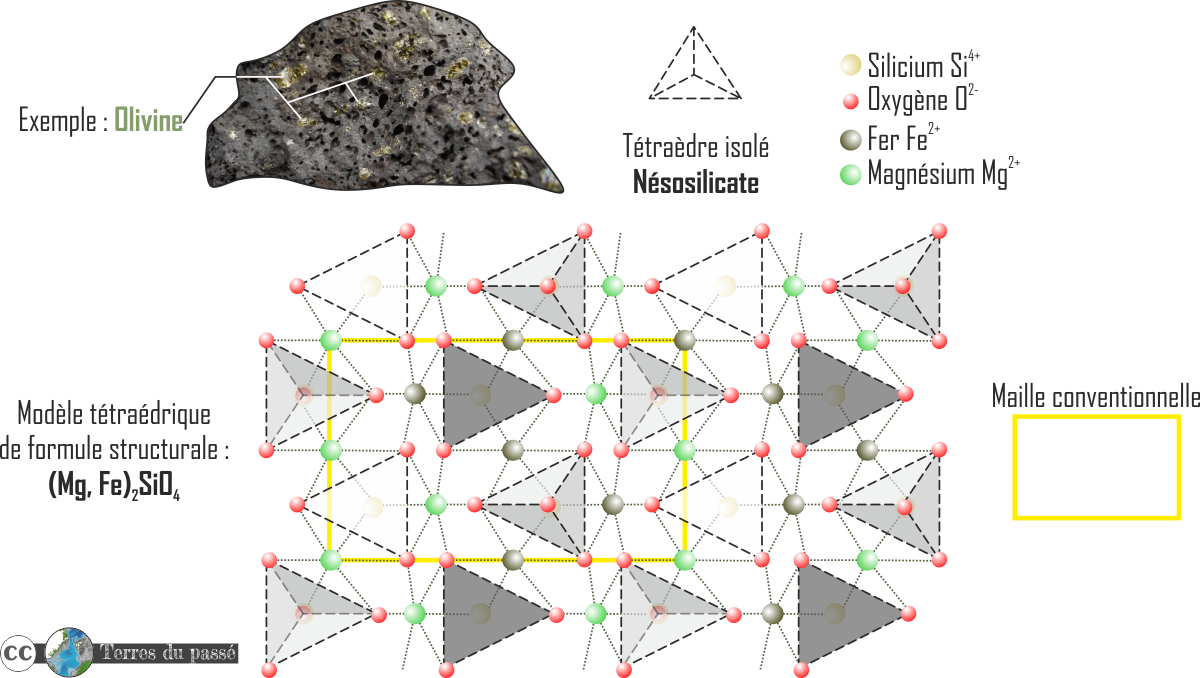
- Les silicates isolés : les nésosilicates.
Ils se composent d'un silicium et quatre oxygènes (SiO4)4-.
Pour compléter ce manque de charge, des atomes de magnésium Mg2+ et/ou fer Fe2+ s'ajoutent à la molécule. Ça donne l’olivine de formule: (Mg,Fe)2SiO4. Dans le même genre, il y a le grenat, la staurotide.
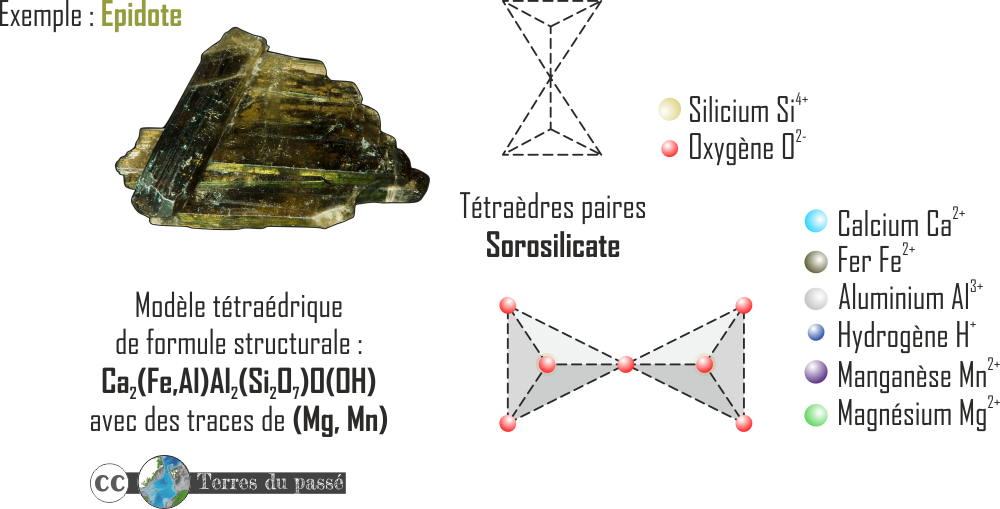
- Les silicates paires : les sorosilicates.
Au niveau de polymérisation supérieur, donc en reliant deux tétraèdres par un sommet et en mettant un oxygène en commun, on obtient un sorosilicate, de formule (Si2O7)6- . Un exemple de sorosilicate est l'épidote (voir l'article de Park et al. (2020) pour de plus amples informations).
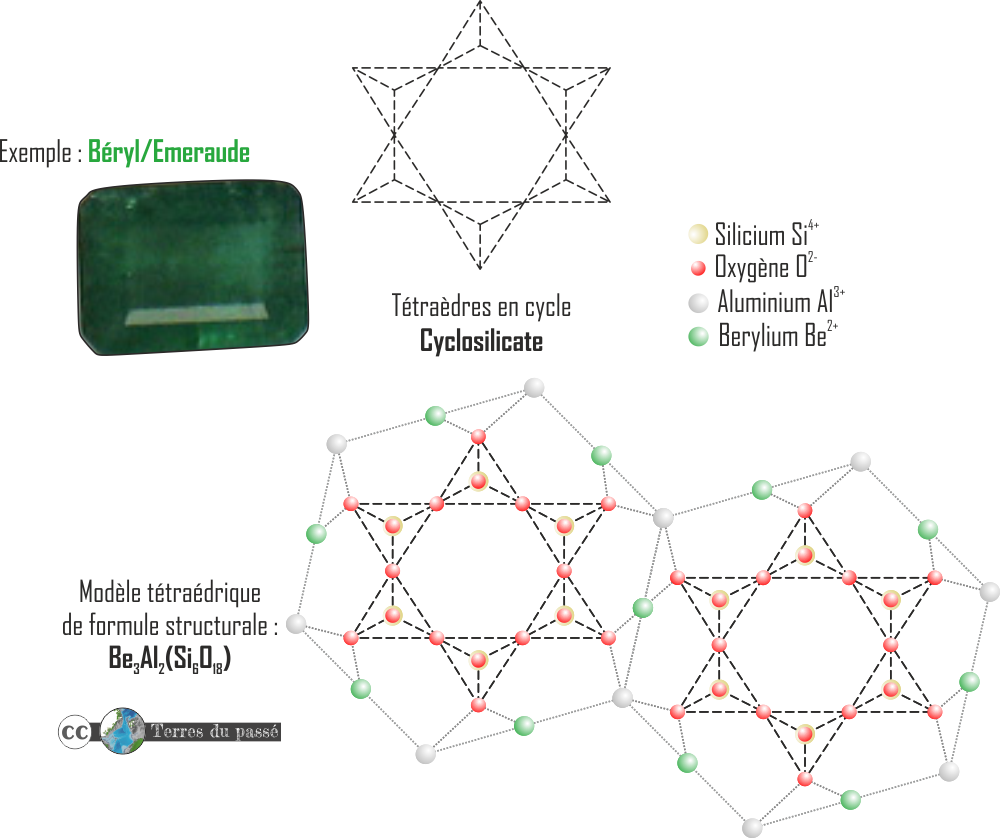
- Les silicates en cycle : les cyclosilicates.
Ce sont des motifs géométriques fermés mettant six tétraèdres ensembles, de formule (Si6O18)12-.
Dans ce cas, il y a un deficit de 12 charges négatives compensé par le Be3Al2. Cela donne par exemple le béryl.
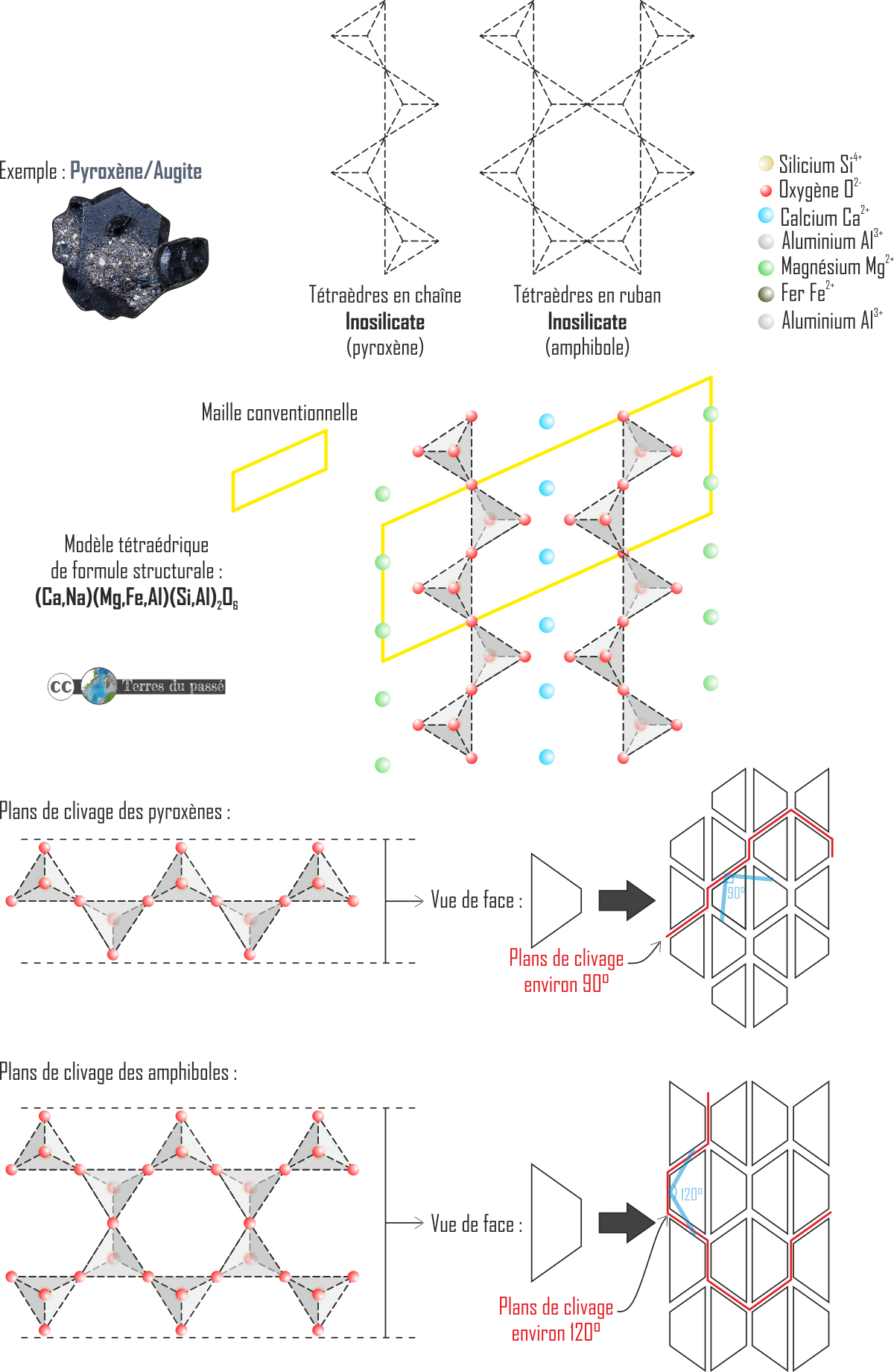
- Les silicates en chaînes : les inosilicates (en chaîne simple ou double).
Ceux qui se composent de chaînes simples de tétraèdres sont construits en mettant oxygènes (O) en commun de chaque côté des pyramides, ce qui donne une formule de base avec 8 oxygènes : (Si2O8)4-.
Par exemple : le pyroxène. Dans l’espace, des plans de fragilité peuvent être définis dans l'espace à l’échelle du minéral : ce sont des plans de clivage. Ce sont les plans préférentiels par lesquels il est possible de casser un minéral donné. Les plans de clivages sont un des critères de reconnaissance des pyroxènes.
Parmi les inosilicates, il y a également les amphiboles. Ce minéral a une structure en rubans de tétraèdres : (Si4O11)6-.
En volume, les amphiboles ont des plans de faiblesse à 120°, ce sont d'autres plans de clivages dont l'angle est un critère de reconnaissance des amphiboles.
- Les silicates en feuillets : les phyllosilicates ;
Ce sont également des rubans de tétraèdres mais avec une polymérisation suivant les deux directions du plan. Ces silicates sont de formule : (Si4O10)4-.
Ils sont plus complexes. Cette famille est abondante et les minéraux en feuillets sont fréquents dans les roches magmatiques. Leur clivage est également en feuillet.
Par exemple, les argiles sont des phyllosilicates : alternance et empilement de feuillets de tétraèdres et de feuillets d’octaèdres.
Les différents types d'argile sont définis en fonction de la variation des ouvertures et des espaces entre les feuillets. Cette structure particulière, laissant un léger espace entre les feuillets, permet à des éléments de venir s'insérer dans ces espaces. Ces éléments "squatteurs" sont de nature variée et peuvent être très facilement mobilisable : ils entrent et sortent facilement.
Ces éléments sont appelés des cations échangeables, car ils sont facile à échanger entre l’argile et le milieu extérieur.
Sur Mars, la présence d’argile fait penser qu’il y a eu de l’eau liquide, car certaines argiles sont hydratées et ont donc besoin de milieu liquide pour se former.
Les argiles sont d’excellents imperméables et sont important dans la dépollution.
- Les silicates en volume : les tectosilicates.
Un exemple de tectosilicate est le quartz. Les quatre sommets du tétraèdre sont en commun. La formule : SiO2. Cela correspond au maximum de polymérisation. Le quartz est stable électriquement.
Les feldspath et les quartz sont abondants dans les roches magmatiques.
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans