Comprendre le tableau périodique - Partie 1 - De la forme au contenu
Comprendre le tableau périodique - Partie 1 - De la forme au contenu
Vous trouverez ci-dessous le contenu de cette page lu par Terres du Passé :
Les cases
Commençons par regarder ce que contiennent les cases de ce tableau si coloré :
Les cases à elles seules recèlent de nombreuses informations. Partons de l'extérieur pour aller petit à petit vers l'intérieur.
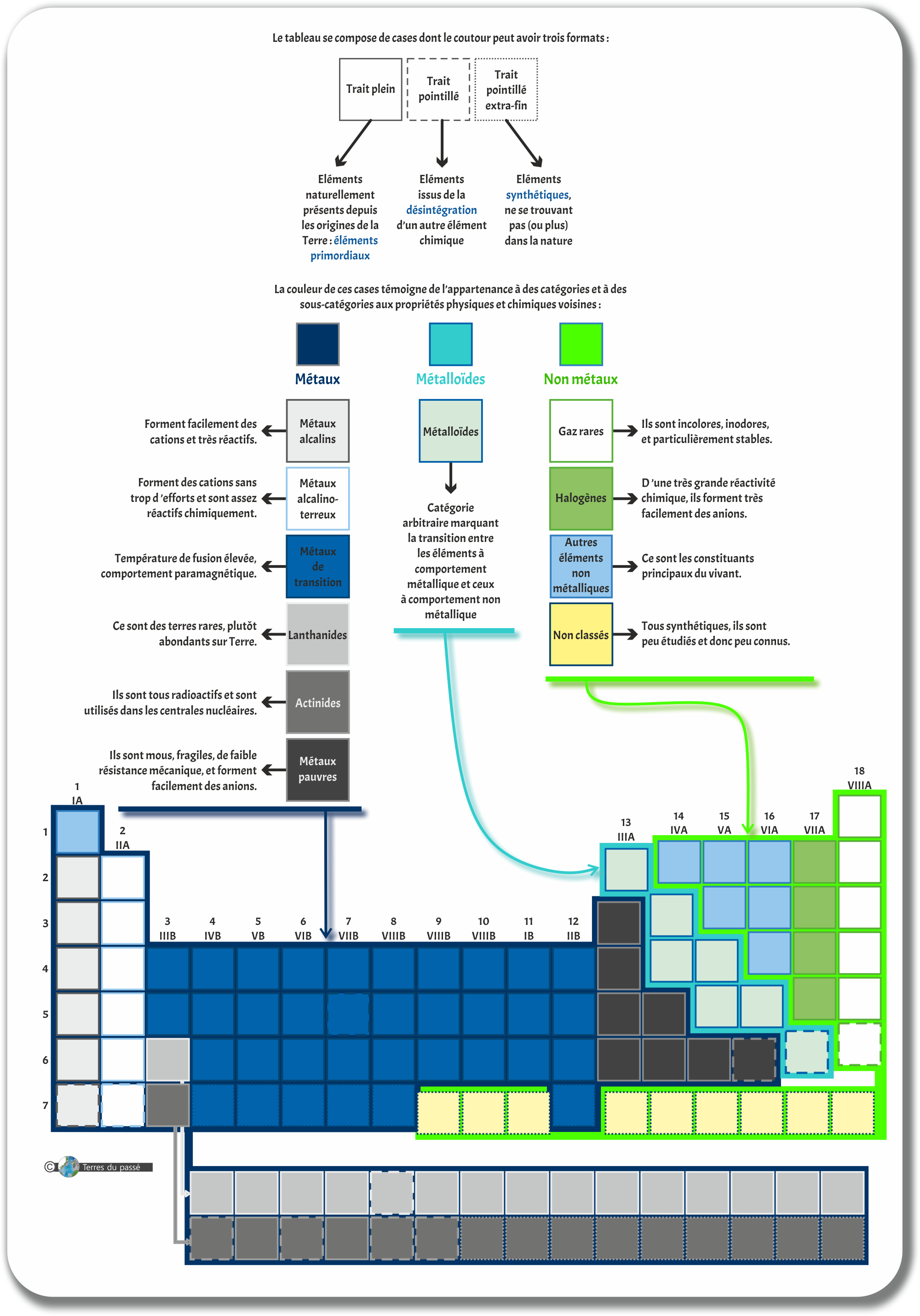
Le contour déjà !
Il peut prendre trois formes différentes :
 |
Le contour en trait plein signifie que l’élément chimique est un élément primordial : l'élément chimique (ou au moins un de ses isotopes (nous reviendrons sur la définition de ce mot dans les parties suivantes)) est présent sur Terre ou un autre objet du Système Solaire depuis sa formation. |
 |
Lorsque l'élément chimique est entouré d'un trait pointillé large, il est le produit de la désintégration d'un autre élément (nous reviendrons égalemement sur cette notion dans les parties suivantes). |
 |
Enfin, lorsque le contour de l'élément chimique est un pointillé très fin, cela signifie que l'élément est synthétique (ou artificiel) : il ne se retrouve pas dans la nature, il est le fruit d'une réaction nucléaire. Cela peut, par exemple, être un élément chimique qui existait sur Terre lors de sa formation mais qui s'est entièrement désintégré depuis. Malgré tout, on peut le retrouver dans les centrales nucléaires. |
En résumé, il y a trois origines différentes des éléments :
- Les primordiaux,
- Les fils de la désintégration radioactive,
- Les synthétiques.
Bien ! Le contour, c'est compris !
Quand on regarde tout le tableau, on se rend compte qu'il y a essentiellement des éléments primordiaux. Les éléments synthétiques sont majoritairement dans la dernière ligne et les éléments issus de la désintégration radioactive se répartissent globalement dans le bas du tableau. Nous aurons l'occasion d'en rediscuter !
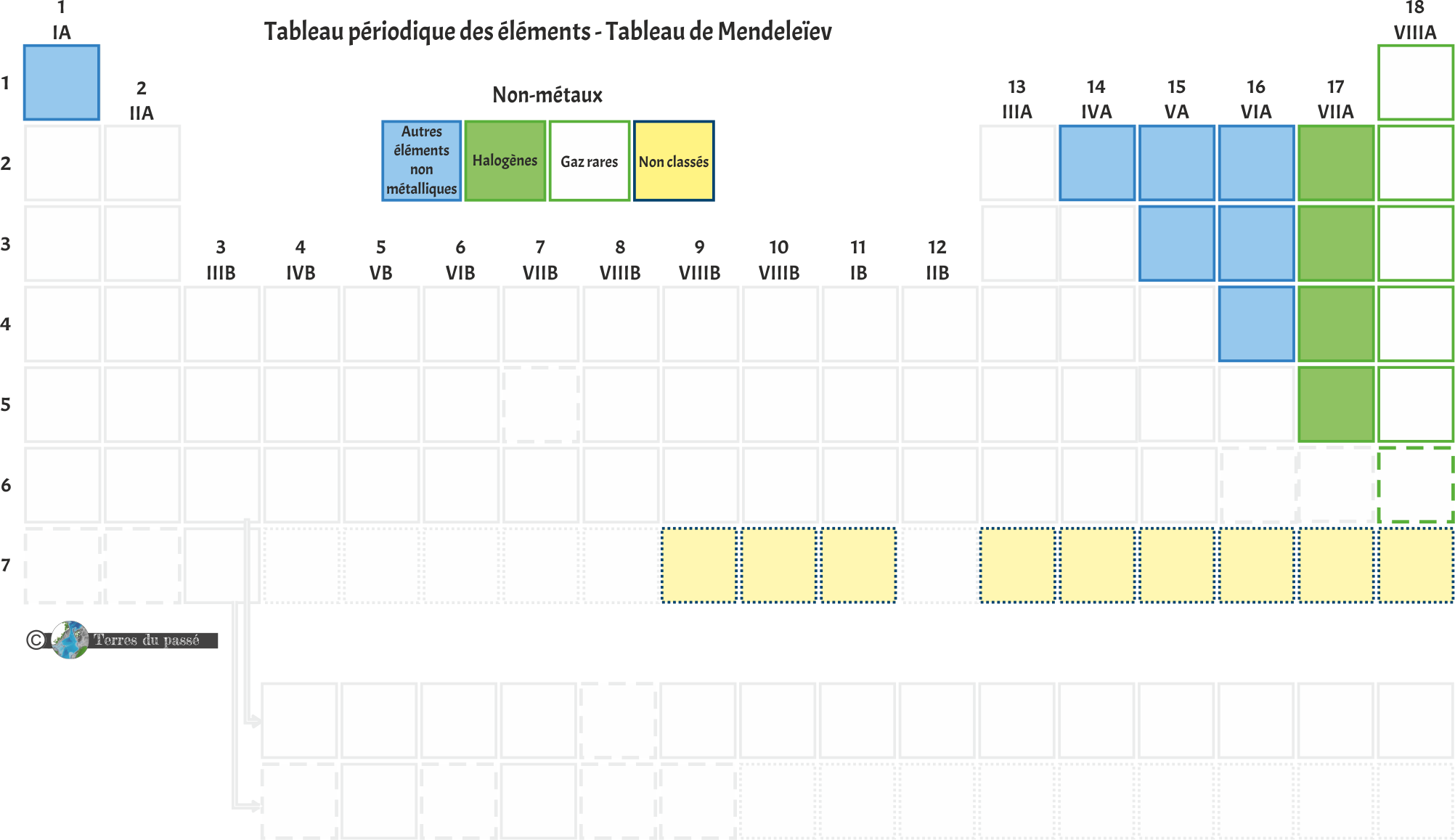
La couleur ensuite !
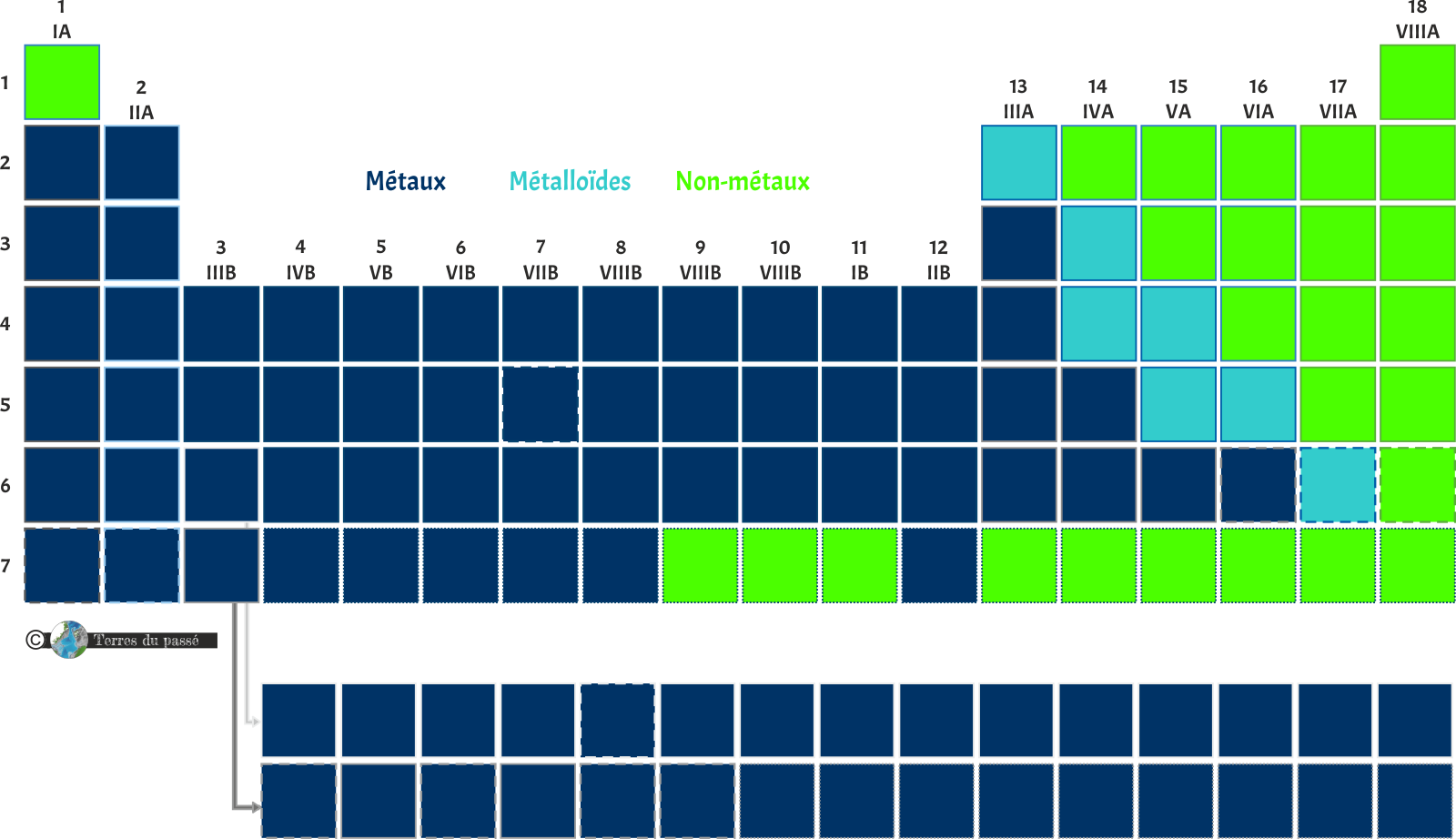
Ensuite, chaque case a une couleur. Les couleurs vont se diviser en trois catégories principales :
|
Les métaux |
Les métaux ont des propriétés chimiques métalliques et leurs comportements sont proches. Ils ont une bonne conductivité thermique et électrique, ainsi qu'une densité généralement élevée. |
|
Les métalloïdes |
Les propriétés physiques des métalloïdes sont souvent à l'intermédiaire entre celles des métaux et des non métaux. Plutôt fragiles, ils sont de mauvais conducteurs thermiques et d'électricité. |
|
Les non-métaux |
Dans le cas des non-métaux, les atomes sont liés par liaisons covalentes ou intermoléculaires plutôt que par des liaisons métalliques. Ce sont de bons isolants électriques et thermiques. |
Bien, donc sur ces trois catégories, celle des métaux, en bleu foncé, ressort clairement comme étant majoritaire. C'est la catégorie la plus représentée. Les métalloïdes, en turquoise, sont intermédiaires, sorte de limite de transition permettant de rejoindre les non-métaux, en vert fluo.
Note de ©Terres du passé : une information qui ne manque pas d'intérêt sur les métalloïdes : il faut dire que leur désignation n'est pas clairement définie. Donc selon les auteurs, certains métalloïdes présentés ici comme tels pourront être placés plutôt dans les métaux ou dans les non métaux. Et inversement, certains éléments limitrophes des métalloïdes pourront être classés comme métalloïdes. La répartition présentée ici est la plus généralement retrouvée.
Toutefois, le tableau périodique ne présente pas seulement 3 couleurs, mais 11 !
Cela signifie qu'il y a des sous-catégories dans ces trois catégories principales. Les sous-catégories apportent des informations aussi bien sur les caractéristiques physiques et chimiques des éléments, que sur leur structure atomique. Afin de rendre le tableau plus utilisable, l'information portant sur les couches électroniques est indiquée ici, en vert, bien qu'elle soit expliquée en détails dans les parties suivantes.
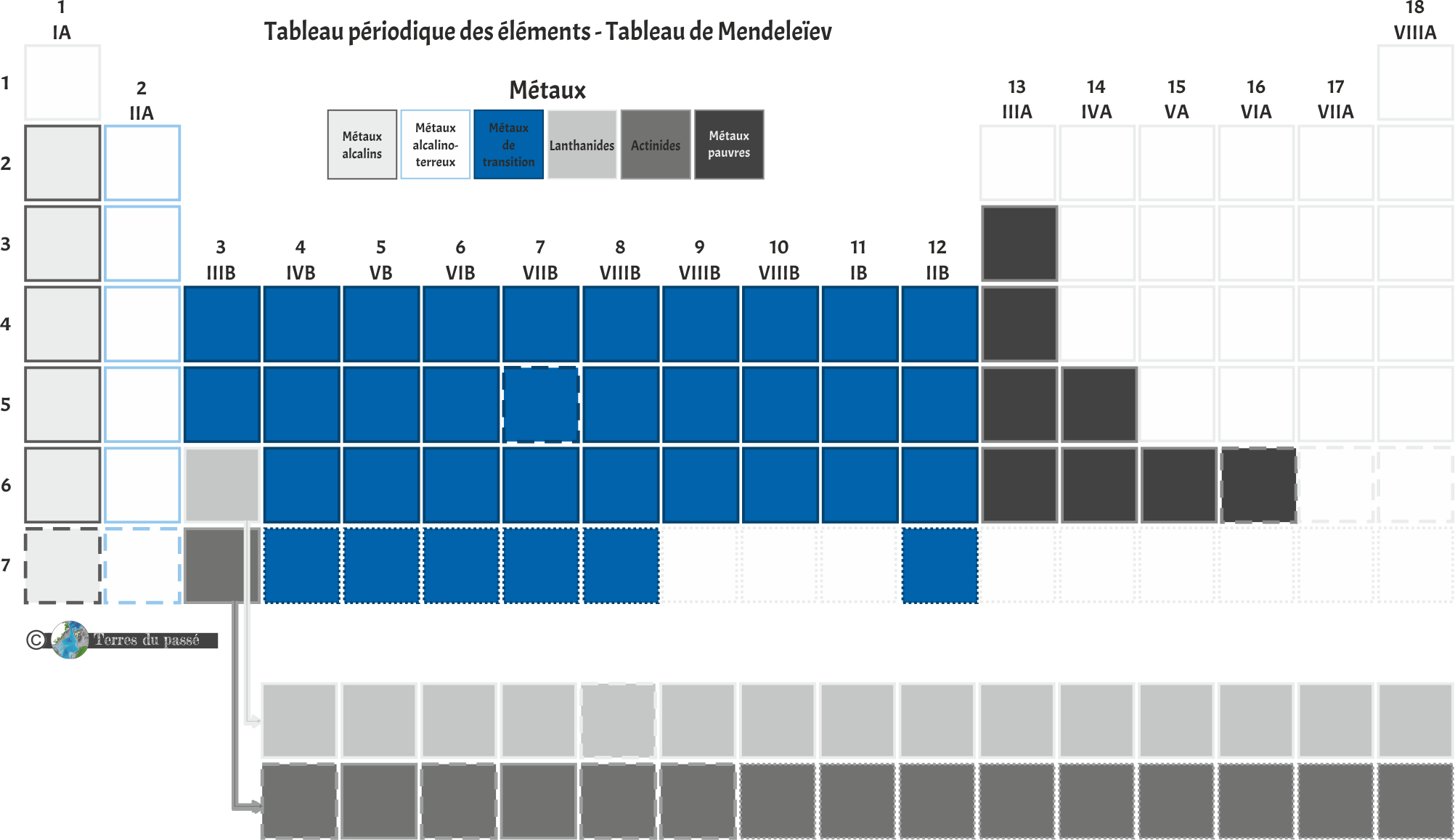
Les métaux
 |
Les alcalins se trouvent dans la première colonne, tout à gauche du tableau périodique. Ce sont tous des métaux brillants, mous, et très réactifs dans les conditions normales de pression et de température. Ce sont des métaux de la sous-couche électronique s, portant 1 seul électron dans leur couche de valence. Ils forment facilement des cations en perdant cet électron (cela les rend plus stables et leur permet de faire aisément des liaisons chimiques). |
 |
Les alcalino-terreux sont blancs-argentés, brillants et chimiquement assez réactifs à température et pression ambiante.
Ces métaux résistent au feu et restent solides à température élevée. Ce sont également des métaux de la sous-couche électronique s, portant 2 électrons dans leur couche de valence. Ils forment facilement des cations en perdant ces 2 électrons (comme les alcalins, cela les rend plus stables et leur permet de faire aisément des liaisons chimiques). |
 |
Les métaux de transition ont une masse volumique et une température de fusion élevées. Ils ont une faible différence d'énergie entre leurs états d'oxydation. Ils peuvent aussi former des composés paramagnétiques. La sous-couche électronique d est incomplète. |
 |
Les lanthanides font partie des terres rares (malgré ce nom, ils sont assez abondants dans la croûte) et ont presque tous des propriétés similaires au Lanthane, d'où le nom de cette sous-catégorie. Métaux brillants à l'éclat argenté. Ils sont de moins en moins mous à mesure que leur numéro atomique augmente. Ils forment des cations trivalents et leur chimie est déterminée par leur rayon ionique. |
 |
Les actinides sont des métaux lourds aux propriétés proches de celle de l'Actinium, d'où leur nom. Ils sont tous radioactifs et libèrent de l'énergie par désintégration radioactive. Ils sont utilisés dans les réacteurs nucléaires. Les actinides présentent un nombre de valence variable et ont un rayon atomique ainsi qu'un rayon ionique élevés. |
 |
Les métaux pauvres sont positionnés entre les métaux et les métalloïdes. Ils ont des propriétés métalliques moins marquées que les autres. Ils sont mous, fragiles, de faible résistance mécanique et ont un point de fusion inférieur à celui des métaux de transtion. Ils forment facilement des anions. |
Ci-dessous vous est présentée la répartition de ces différentes sous-catégories de métaux dans le tableau périodique des éléments :
Les métaux sont donc divisés en 6 sous-catégories fonctions de leurs caractéristiques physico-chimiques et de leurs comportements électroniques.
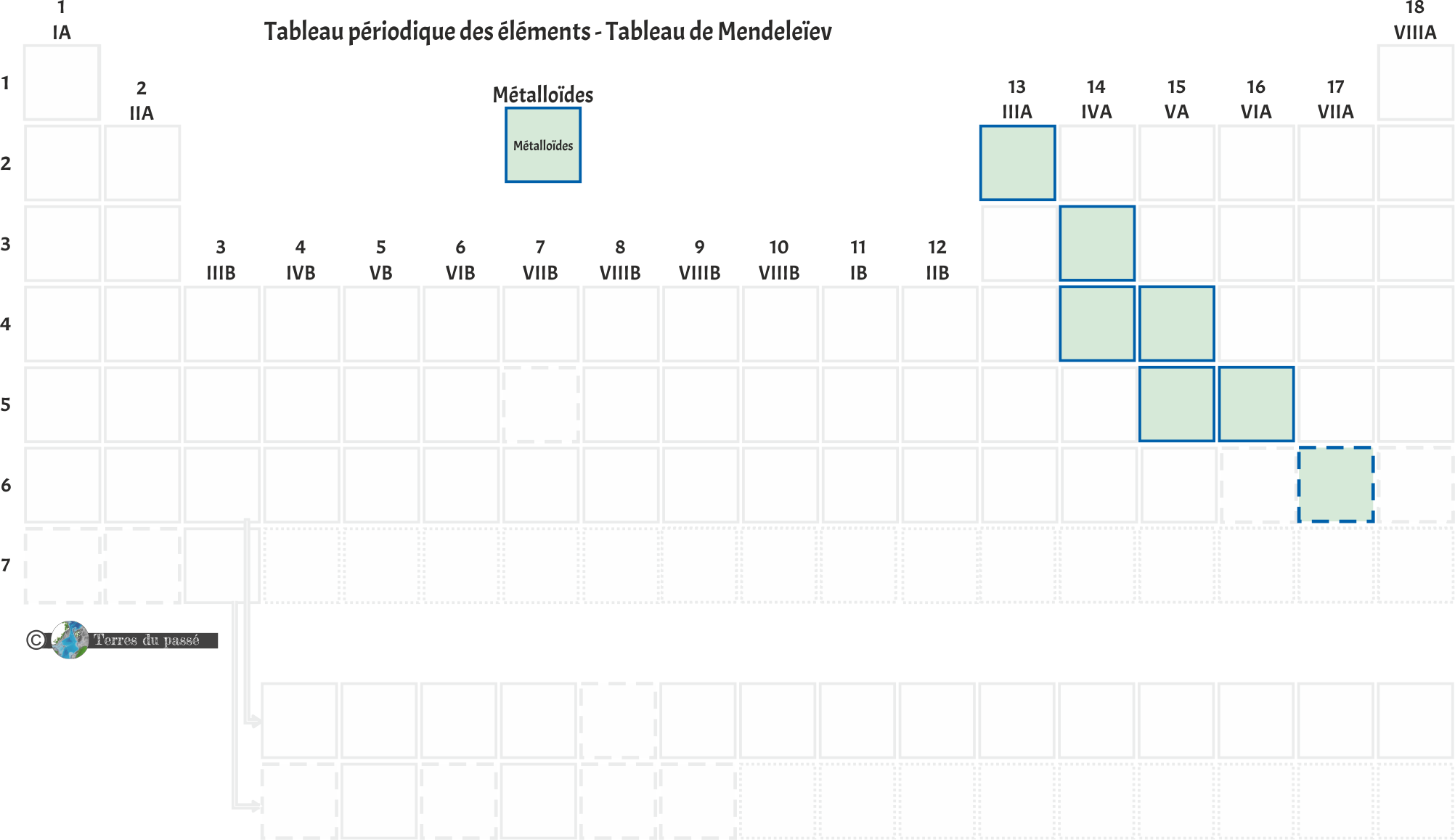
Les métalloïdes
Les métalloïdes ne comprennent aucune sous-catégorie :
Les non-métaux
Les non-métaux, quant à eux, présentent 4 sous-catégories :
 |
Les halogènes sont très réactifs chimiquement. À 0°C et à pression atmosphérique normale, leur état standard est gazeux et diatomique. Ils forment des anions très facilement, ce qui leur facilite la réalisation de liaisons chimiques. |
 |
Aussi appelés des gaz nobles, les gaz rares sont incolores, inodores et très peu réactifs chimiquement en raison de leur très grande stabilité. Leur température d'ébullition est très basse, toujours inférieure à 10°C. Leur couche de valence est saturée, ce qui explique leur faible réactivité chimiques : ils ne produisent pas de liaison covalente facilement. |
 |
Les autres éléments non métalliques sont les constituants principaux de la matière vivante. Les éléments de cette catégorie sont ainsi souvent désignés sous le terme CHNOPS, qui permet d'identifier tous les éléments indispensables à la vie (notamment dans la recherche d'exoplanètes). |
 |
Très peu de choses sont connues sur les éléments chimiques non classés, tous synthétiques, donc issus de la désintégration dans les usines et centrales nucléaires. |
Voilà pour la question des couleurs !
Rien que sur le format du tableau périodique, sans parler du contenu des cases, il y a déjà beaucoup d'informations qui nous sont données ! Ci-dessous, voici une petit synthèse de tout ce que nous venons de voir :
À présent que nous savons identifier les catégories d'un premier regard, penchons-nous sur le contenu des cases !
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans