 Comprendre le tableau périodique des éléments - Partie 3 - Les lignes et les colonnes
Comprendre le tableau périodique des éléments - Partie 3 - Les lignes et les colonnes
Vous pouvez écouter le contenu de cette page lu par Terres du Passé juste ici :
Bonjour et Bienvenue !
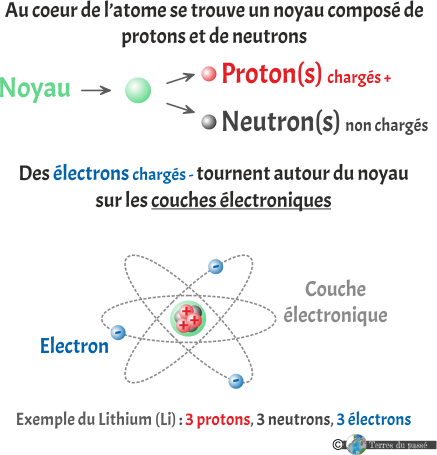
Nous avons donc vu, dans les Partie 1 et Partie 2, comment comprendre le forme, la couleur et le contenu des cases du tableau périodique. À présent, nous allons nous intéresser à la construction du tableau.
Pour commencer, nous allons le simplifier un peu : pour le moment, conservons simplement le numéro atomique des éléments, leur symbole et leur nom.
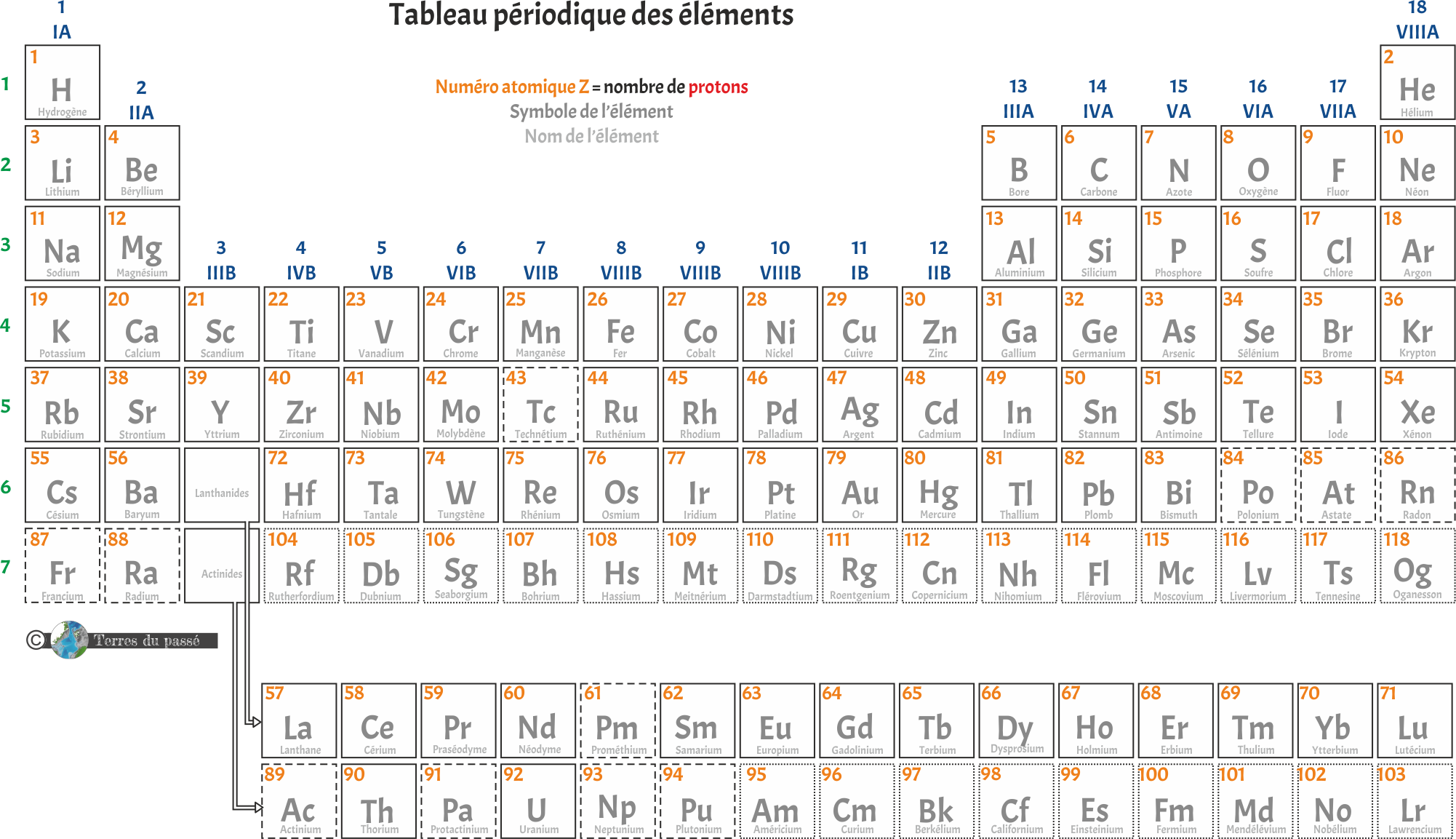
Les colonnes
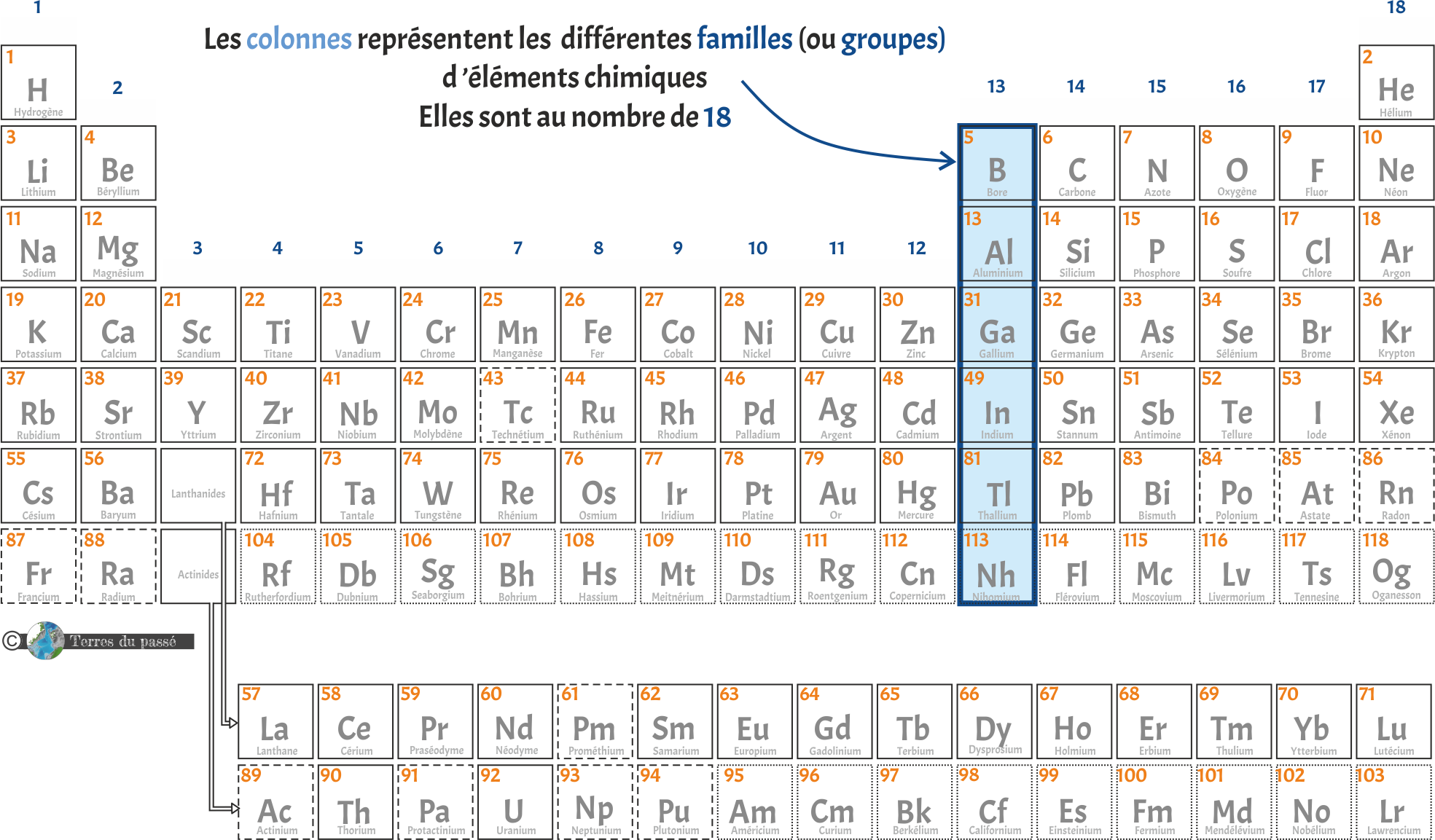
Les colonnes sont au nombre de 18, ici représentées en bleu. Elles correspondent aux différentes familles chimiques, ou groupes. Les éléments d'une même famille (donc d'une même colonne) ont des propriétés semblables. Ils ont tendance à avoir le même comportement : les atomes y ont le même nombre d’électrons sur leur couche externe.
Les lignes
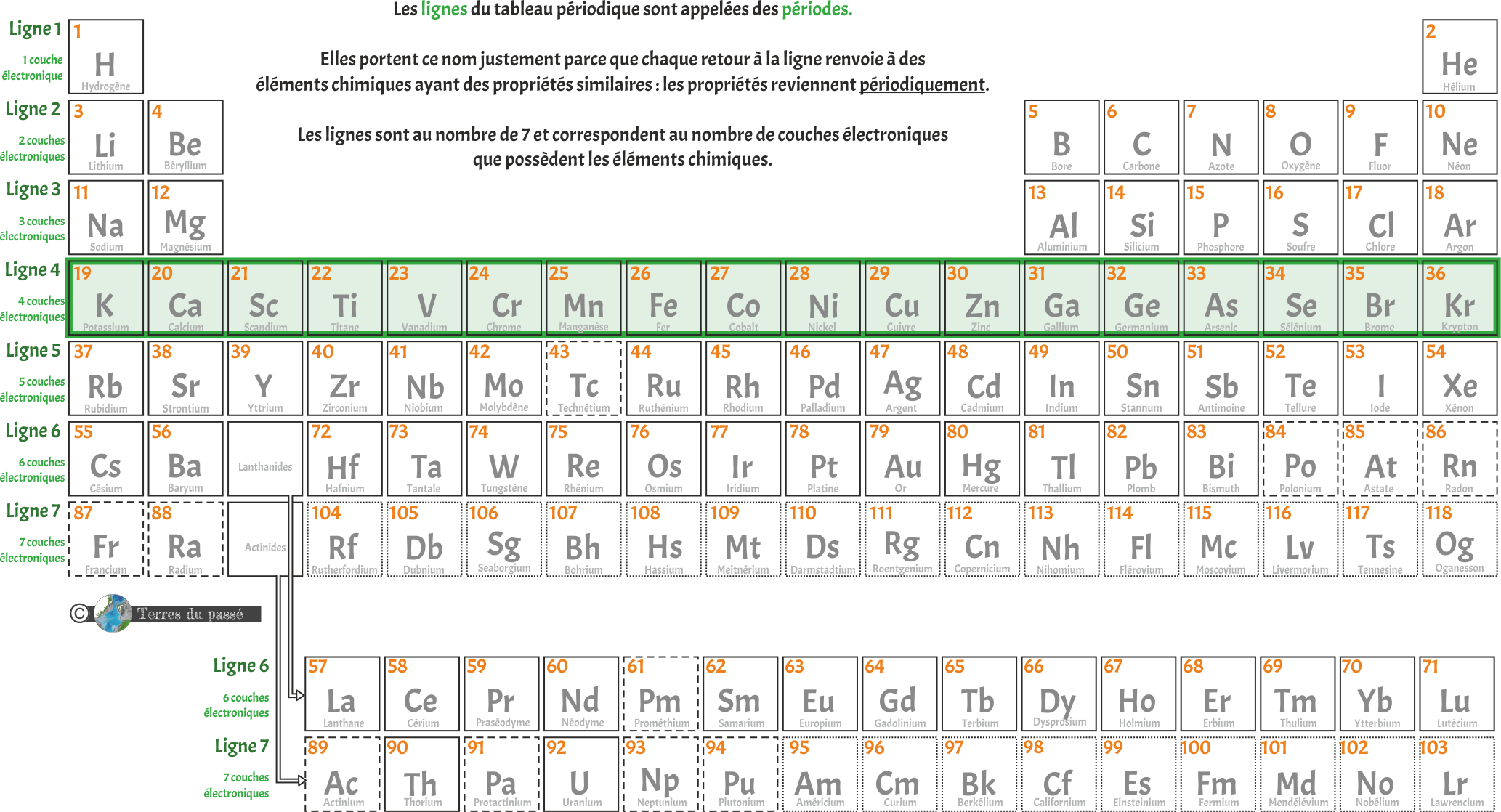
Le tableau contient donc 7 lignes, numérotées de 1 à 7 (ici en vert). Chaque ligne du tableau périodique est appelée une période. Elles portent ce nom justement parce que chaque retour à la ligne renvoie à des éléments chimiques ayant des propriétés similaires : les propriétés reviennent périodiquement.
Chaque ligne correspond à une couche électronique : les éléments de la ligne 1 ont une couche électronique, les éléments de la ligne 2 ont deux couches électroniques, etc. (les parties suivantes donnent des explications détaillées sur les couches électroniques).
Vous constatez que les lanthanides font partie de la ligne 6 et les actinides de la ligne 7. Ces deux lignes sont extraites du tableau pour une simple question de visualisation.
Pourquoi y a-t-il des trous dans le tableau périodique ?
À présent que l'on sait comment sont construites les colonnes (éléments ayant des comportements similaires) et les lignes (éléments ayant le même nombre de couches électroniques), nous commençons à disposer des clés nécessaires pour comprendre l'existence des espaces blancs.
Regardons de manière un peu plus approfondie les lignes de notre tableau. De gauche à droite et de haut en bas, le numéro atomique Z augmente. En fait, chaque case contient un proton de plus que l'élément qui le précède (et donc un électron de plus, les éléments chimiques étant électriquement neutres) :
De fait, il serait logique de penser que l'hélium (He), portant le numéro atomique Z = 2, devrait se trouver à côté d'hydrogène (H) portant le numéro atomique Z = 1.
Sauf qu'il faut prendre en compte, dans chaque ligne, le comportement de l'élément, et donc la famille (la colonne) correspodante. Chaque famille porte un nom inscrit en chiffres romain : la première colonne fait partie de la famille I (1), la deuxième colonne de la famille II (2), la troisième de la famille III (3), etc.
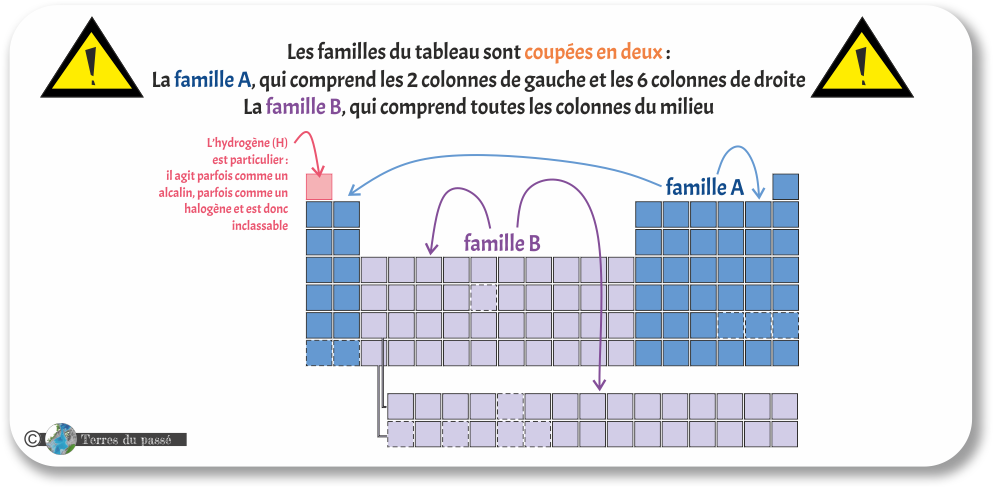
Attention ! Les familles du tableau sont coupées en deux :
- Les familles du groupe A, qui comprend les 2 colonnes de gauche et les 6 colonnes de droite (en bleu dans la figure ci-dessous). Ces familles sont numérotées en chiffres romains de IA à VIIIA. Les éléments à l'intérieur des familles de ce groupe ont des caractéristiques vraiment proches, ce qui les rend très intéressants à étudier.
- Les familles du groupe B (en violet dans la figure ci-dessous) correspondent en fait à tous les métaux de transition, aux lanthanides et aux actinides. Les colonnes y sont également numérotés en chiffres romains, de IB à VIIIB, mais avec quelques subtilités que nous verrons dans les parties suivantes.
Ce que nous venons de voir peut être synthétisé comme suit :
Bien ! Nous venons de voir, par ces trois premières parties, beaucoup de choses qui nous permettent d'avoir une vue d'ensemble assez complète du tableau périodique.
La partie suivante détaille le contenu des familles chimiques. Alors vous êtes prêts ? 3... 2... 1... GO !
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans
.png)



.png)