Comprendre le tableau périodique - Partie 2 - Le contenu des cases
Comprendre le tableau périodique - Partie 2 - Le contenu des cases
Vous trouverez ci-dessous le contenu de cette page lu par Terres du Passé :
Bonjour et Bienvenue !
Nous avons vu dans la partie précédente à quoi correspondait le format du tableau périodique. À présent, nous allons nous pencher sur le contenu des cases. Et elles sont riches d'informations !
Les 4 cases présentées ci-dessous contiennent tous les différents types de données que vous pouvez trouver dans le tableau :
Afin de ne pas s'embrouiller avec des informations qui ont déjà été expliquées (la couleur du fond et le format du contour) et de nous concentrer sur ce qui nous intéresse, simplifions un peu ces éléments :
Bien ! Voilà qui est mieux ! À présent, voyons ce que nous révèlent ces cases...
En haut à gauche, on trouve le numéro atomique de l'élément chimique. Ce numéro, aussi noté Z, indique le nombre de protons présents dans le noyau.
Pour rappel, les protons sont les particules élémentaires chargées positivement, liées aux neutrons (charge neutre), qui se trouvent dans le noyau des atomes. Les éléments chimiques étant électriquement neutres, il y a autant d'électrons (chargés négativement) tournant autour du noyau des atomes que de protons présents. La question du numéro atomique et du nombre de proton sera approfondie dans les parties suivantes.
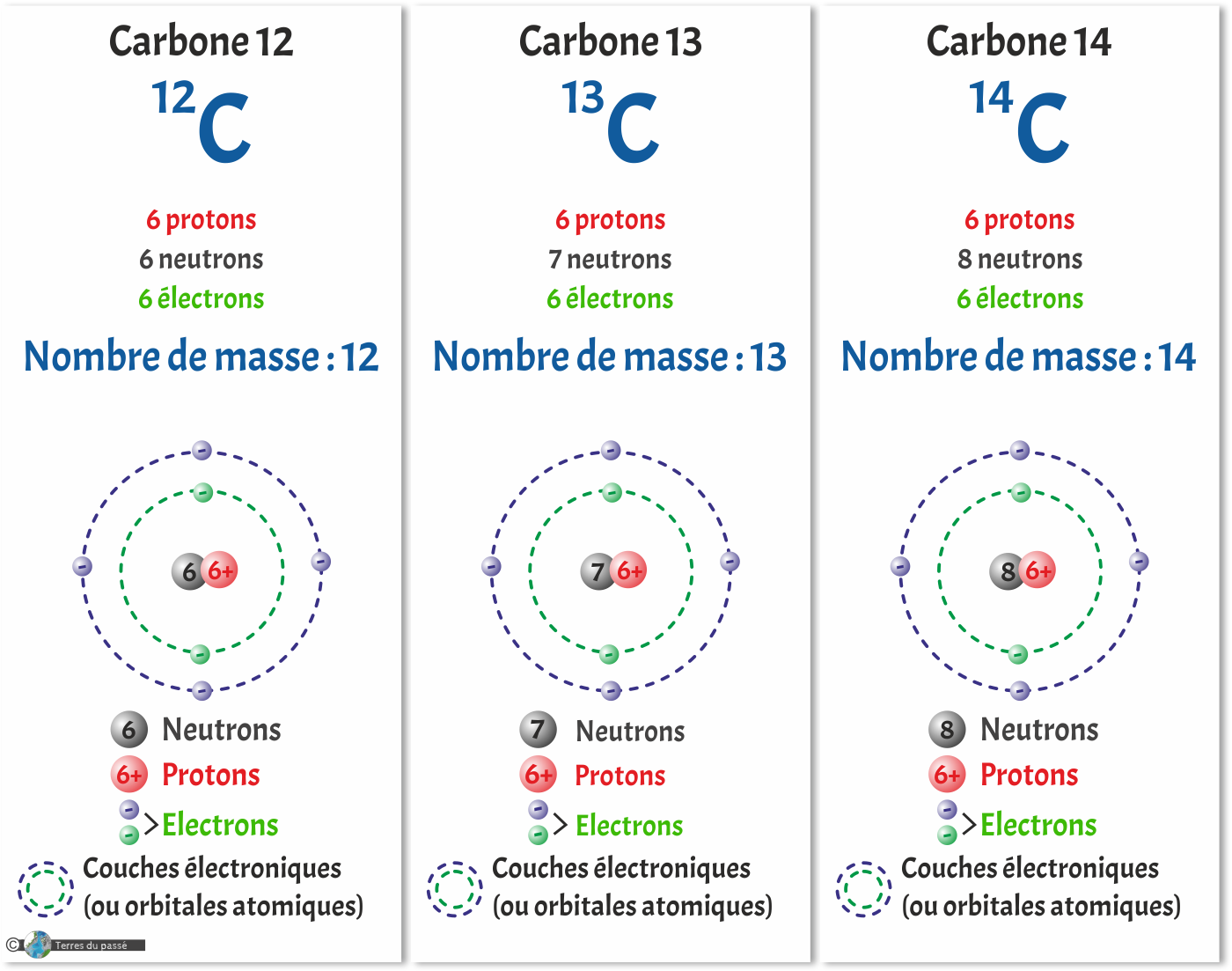
En haut à droite, il y a le nombre de masse de l'isotope le plus le plus abondant. Le nombre de masse est un nombre entier donnant le poids de l'atome en fonction du nombre de protons et de neutrons présents dans le noyau.
Comme nous l'avons vu quelques lignes plus haut, en principe, il y a autant de neutrons que de protons dans le noyau. Cependant, dans les faits, ce n'est pas toujours le cas. Parfois, le nombre de neutrons diffère du nombre de protons. Cela ne change pas la charge de l'élément, car les neutrons sont neutres, ni son nom, car le nom dépend du nombre de protons, mais en revanche, cela change sa masse.
Ainsi, un élément chimique peut exister sous plusieurs formes : avec autant de neutrons que de protons, ou avec plus de neutrons que protons. On parle alors d'isotopes.
Par exemple, le carbone a trois isotopes : le carbone 12, le carbone 13 et le carbone 14. Les trois formes existent et ont des caractéristiques légèrement différentes. Dans le cas présent, par exemple, le carbone 14 est radioactif et est utilisé pour faire des datations.
Trois isotopes pour le Carbone :
Ensuite ! Au centre des cases, on trouve le symbole chimique de l'élément :
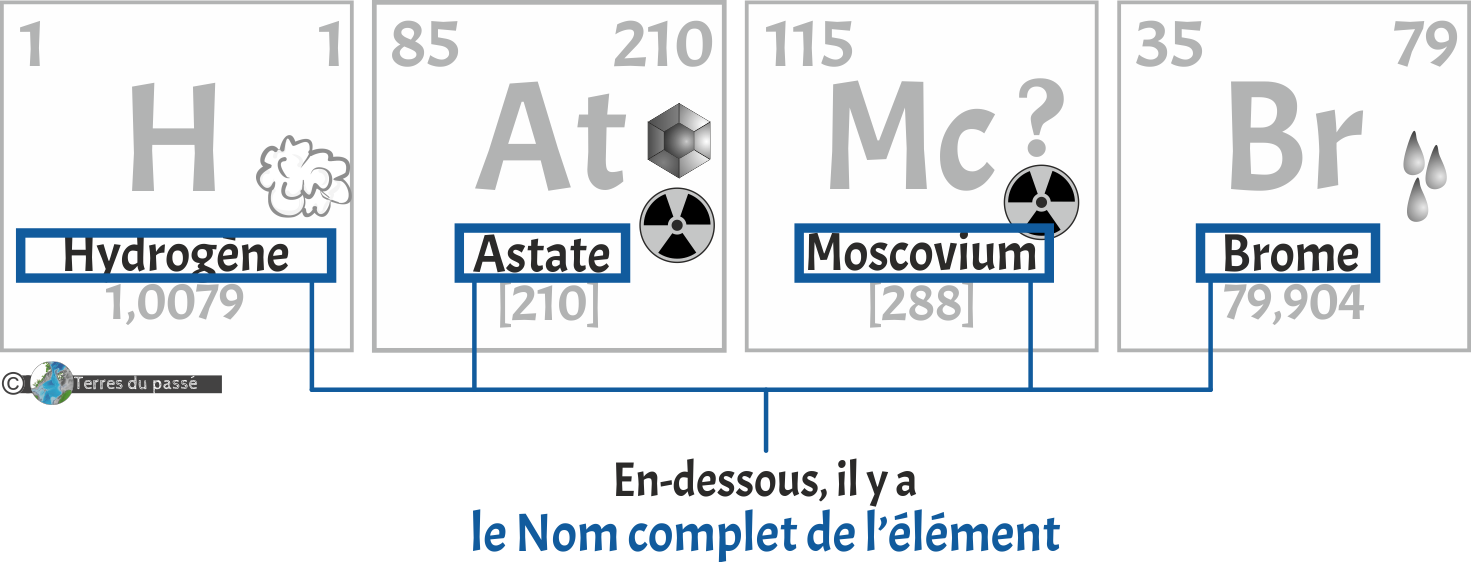
Suivi juste en-dessous par son nom complet :
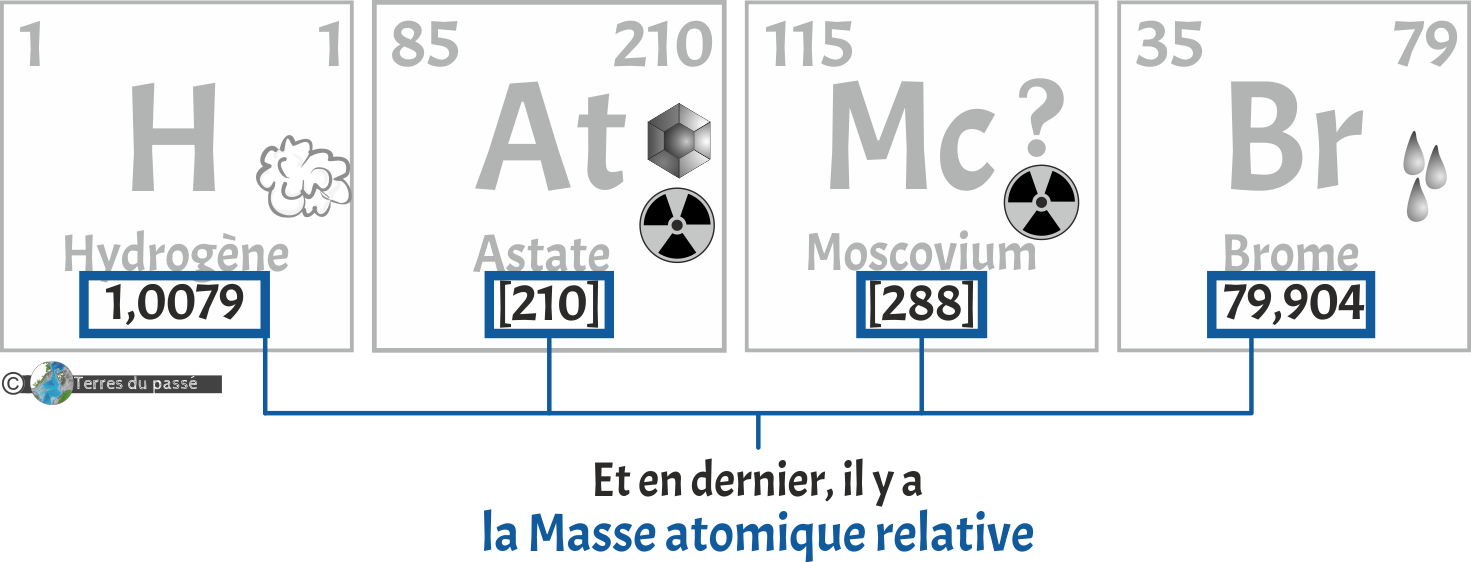
Puis de sa masse atomique relative (ou celle de l'isotope le plus stable) :
Cette valeur se veut la plus proche possible de celle d'un nucléon (ensemble de protons+neutrons dans un noyau atomique). Ce nombre est généralement décimal car il se calcule au prorata de la présence de l'élément et de ses isotopes à la surface de la Terre. Cela permet un calcul plus précis des masses en jeu lors des conditions expérimentales courantes.
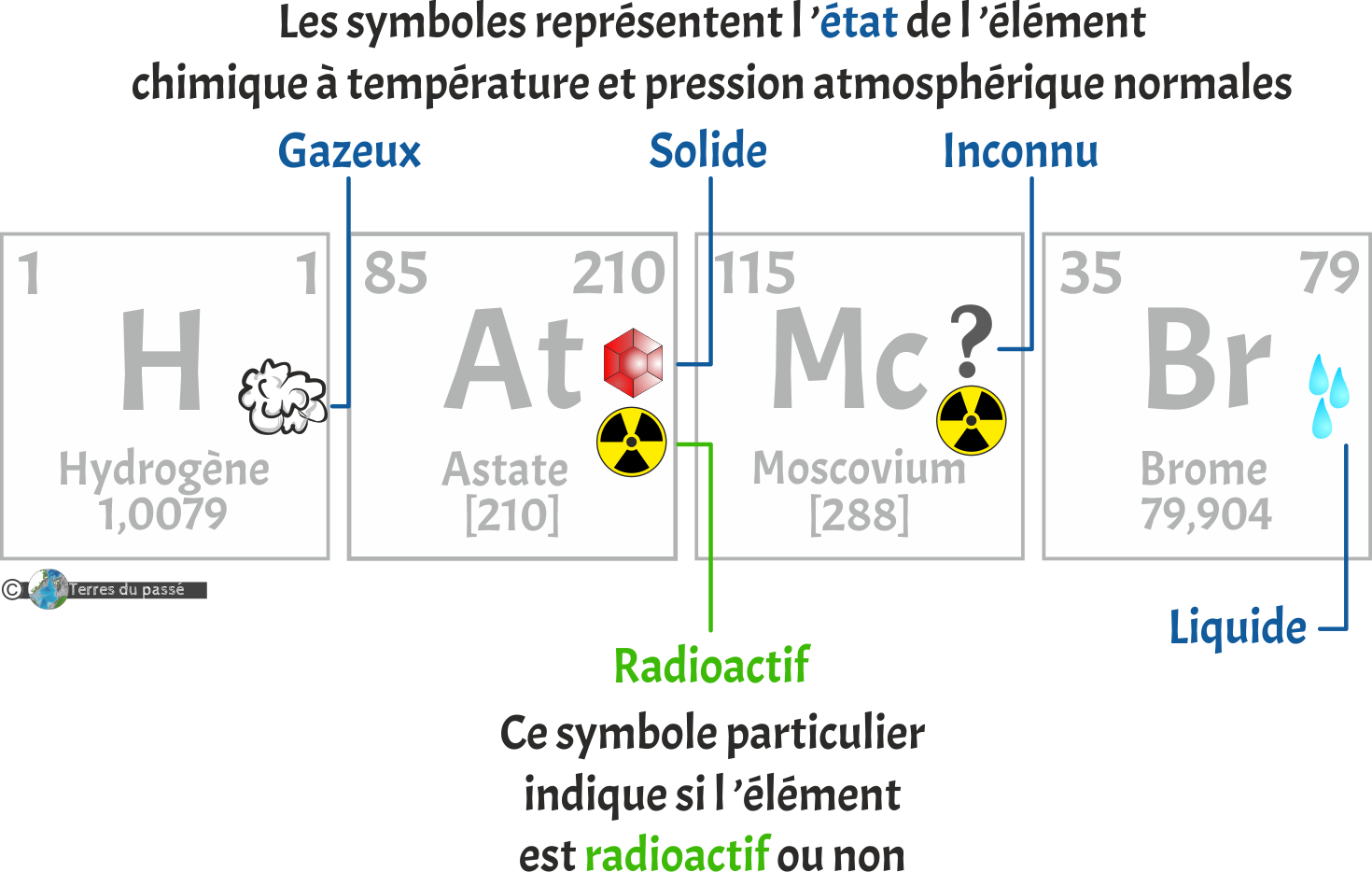
À partir de là, nous avons presque fini de décortiquer le contenu des cases des éléments chimiques. Il nous reste encore à regarder plus en détails les petits symboles présents. Ils sont au nombre de 5 et caractérisent l'état dans lequel se trouve l'élément chimique observé à pression atmosphérique normale et température normale :
Nous pouvons synthétiser tout ce que nous venons de voir comme ceci :
Félicitations d'être arrivé jusque-là !
Déjà, rien qu'avec ces deux premiers chapitres, nous avons acquis une bonne compréhension du tableau périodique.
Il reste tout de même encore pas mal de choses à raconter. Les créateurs de ce tableau ont fourni un sacré boulot, ça c'est sûr !
Bien, une petite pause pour respirer et bien intégrer tout ce que nous venons de voir et c'est reparti !
À présent, penchons-nous sur la question de la construction du tableau périodique en expliquant les lignes et les colonnes !
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans