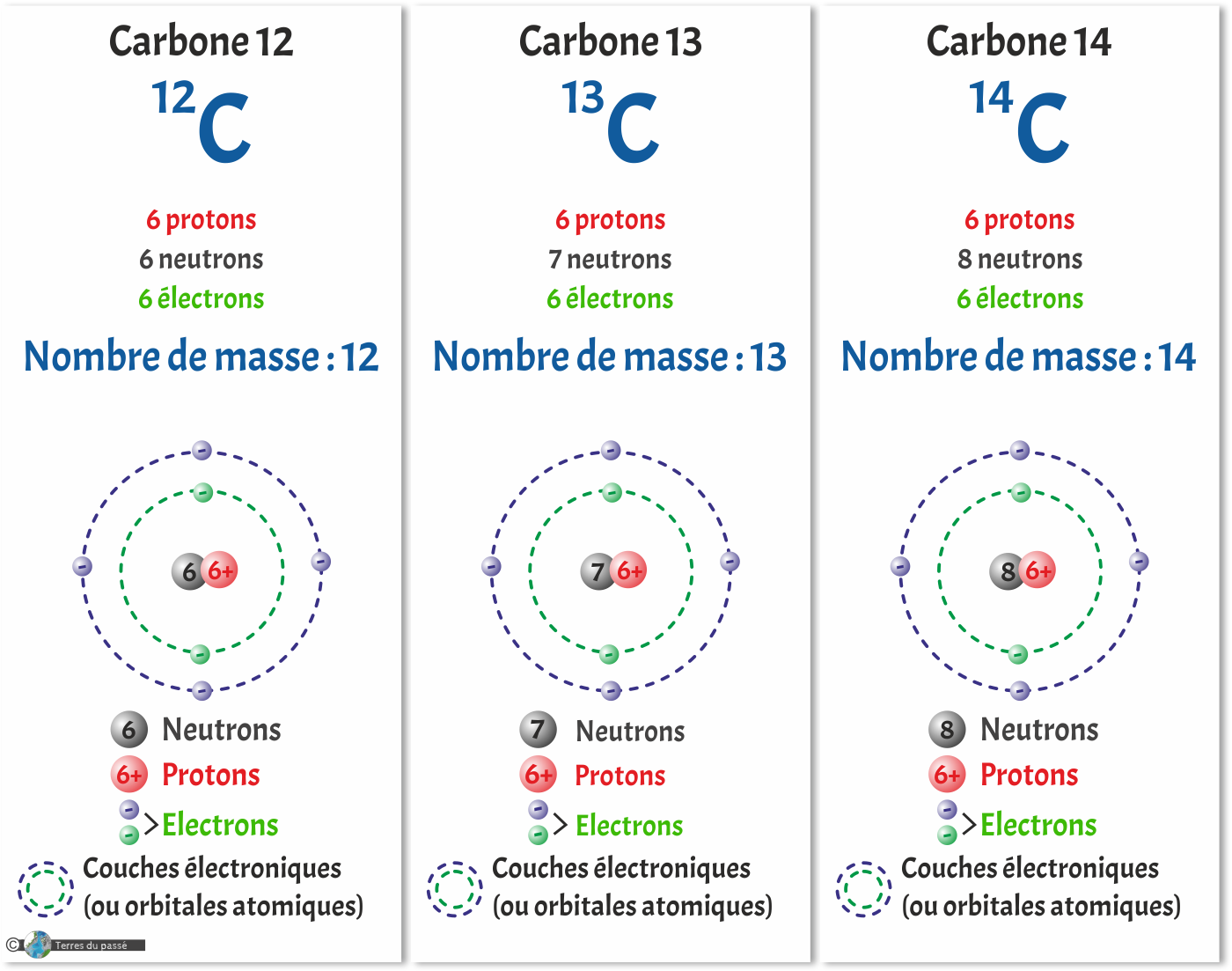
Isotopes
Les isotopes sont les atomes aynt plusieurs nombres de neutrons possibles pour un même nombre de protons.
En chimie, il existe tous les éléments chimiques présentés dans le tableau périodique (ou tableau de Mendeleïev). Un élément chimique est un atome composé d'un nucléus, composé d'un certain nombre de neutrons (sans charge électrique) et de protons (ayant une charge électrique positive), et entouré d'un nuage électronique (les électrons ayant une charge électrique négative).
Les éléments chimiques étant électriquement neutres, ils ont autant de protons dans leur noyau que d'électrons dans le nuage électronique qui les entoure. Toutefois, le nombre de neutrons peut varier dans le nucléus. Il peut y avoir plus de neutrons que de protons. On parle alors d'isotopes.
L'abondance de neutrons par rapport aux protons dans le nucléus va augmenter la masse atomique et induire une certaine instabilité de l'élément. Ainsi, certains isotopes sont radioactifs : ils se désintègrent dans le temps.
C'est par exemple le cas du carbone, qui a trois isotopes :
- Deux stables : le carbone 12 (le plus abondant) et le carbone 13,
- Et un radioactif : le carbone 14, utilisé notamment pour les datations de tout ce qui a moins de 46 000 ans.
 Terres Du Passé
L'histoire de notre Terre et de nos Océans
Terres Du Passé
L'histoire de notre Terre et de nos Océans